Introdução ao estudo da Eletroquímica
A Eletroquímica é a parte da Química que estuda a produção de corrente elétrica por meio de reações químicas (pilhas e baterias) e o processo inverso a esse (eletrólise).
Por Jennifer Rocha Vargas Fogaça

PUBLICIDADE
A Eletroquímica é um dos ramos da Físico-Química que estuda as relações existentes entre reações químicas e a corrente elétrica.
As reações estudadas na eletroquímica são as de oxidorredução, ou seja, aquelas em que há transferência de elétrons, além de ocorrer, de modo simultâneo, uma oxidação e uma redução de determinadas espécies químicas que participam do processo.
O estudo da eletroquímica pode ser dividido em duas partes: pilhas e baterias, e eletrólise.
-
Pilhas e baterias:
São dispositivos em que ocorre uma reação de oxidorredução que produz corrente elétrica. Isso significa que há uma conversão de energia química em energia elétrica. Esse processo é espontâneo, pois há a transferência de elétrons entre um metal que tem a tendência de doar elétrons (eletrodo negativo – ânodo), por meio de um fio condutor, para um metal que tem a tendência de receber elétrons (eletrodo positivo - cátodo).
A diferença entre as pilhas e as baterias está no fato de que as pilhas possuem apenas um eletrólito e dois eletrodos, enquanto as baterias são formadas por conjuntos de pilhas em série ou em paralelo.
As pilhas ou baterias primárias são aquelas que não podem ser recarregadas. A reação de oxidorredução delas continua por determinado período, fornecendo energia ao sistema até que essa reação química se esgote e o dispositivo pare de funcionar. Um exemplo é a pilha seca de Leclanché ou pilha ácida usada em equipamentos que requerem descargas leves e contínuas, como controle remoto, relógio de parede, rádio portátil e brinquedos.
Já as pilhas ou baterias secundárias são recarregáveis e podem ser utilizadas inúmeras vezes. Um exemplo é a bateria usada em automóveis (baterias chumbo/óxido de chumbo ou chumbo/ácido), que é recarregada quando se fornece uma corrente elétrica contínua, aplicando-se uma diferença de potencial para inverter os polos e mudar o sentido da reação química, fazendo assim com que a bateria funcione e regenere grande parte do ácido sulfúrico.

As baterias dos automóveis são baterias de chumbo, que geram normalmente 12 volts
-
Eletrólise:
A eletrólise é o processo inverso das pilhas e baterias, isto é, uma corrente elétrica gera uma reação química de oxidorredução. A eletrólise é um processo não espontâneo que transforma energia elétrica em energia química.
Existem dois tipos de eletrólises:
* Eletrólise ígnea: é feita com ausência de água. A corrente elétrica passa pela substância iônica na fase líquida (fundida). Um exemplo é a eletrólise do cloreto de sódio (sal de cozinha) fundido, que produz o gás cloro e o sódio metálico.
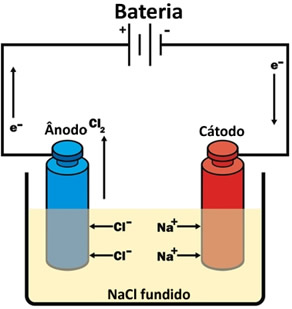
Eletrólise ígnea do cloreto de sódio (sal de cozinha)
* Eletrólise em meio aquoso: nesse caso temos íons fornecidos pela substância dissolvida na água. Um exemplo da utilização da eletrólise é no revestimento de peças com metais que se oxidam mais facilmente que o metal constituinte da peça, protegendo-o contra a corrosão. O nome desse processo é eletrodeposição e pode se dar de duas maneiras principais: por eletrólise de purificação e também por galvanoplastia.
No exemplo abaixo, temos a cobreação de uma chave, ou seja, por meio da eletrólise de uma solução aquosa de sulfato de cobre, a chave será revestida de cobre:
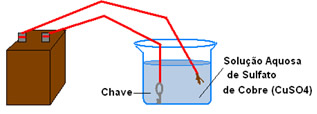
Esquema de cobreação de uma chave
Aproveite para conferir nossa videoaula sobre o assunto:









