Pilhas
As pilhas são dispositivos capazes de produzir corrente elétrica e apresentam diversas composições e aplicações.
Por Diogo Lopes Dias

PUBLICIDADE
Pilhas são dispositivos capazes de produzir corrente elétrica (energia elétrica) a partir de reações de oxidação e redução de componentes metálicos presentes em sua estrutura. Vale dizer que:
-
Oxidação: é a capacidade que um material apresenta de perder elétrons;
-
Redução: é a capacidade que um material apresenta de ganhar elétrons.
Assim, em uma pilha, como os elétrons partem de um componente e chegam até outro, forma-se uma corrente elétrica, que é capaz de fazer funcionar diversos dispositivos eletrônicos.
Funcionamento de uma pilha
Para explicar o funcionamento de uma pilha, vamos utilizar uma das primeiras pilhas construídas, a pilha de Daniell:
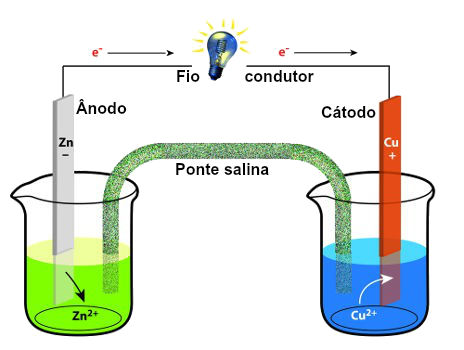
Esquema da pilha de Daniell
Na pilha de Daniell, temos:
-
Um ânodo de zinco (formado por uma placa) imerso em uma solução formada por água e sulfato de zinco (ZnSO4). A placa de zinco, ao sofrer oxidação, libera elétrons, formando o cátion Zn+2, que permanece na solução. Com isso, a placa tem seu tamanho diminuído e a solução fica com excesso de cátions;
-
Um cátodo de cobre (formado por uma placa) imerso em uma solução formada por água e sulfato de cobre (CuSO4). Na solução, existem cátions cobre (Cu+2), os quais, ao receber os elétrons vindos do ânodo, transformam-se em cobre sólido (Cu) e aderem-se à placa. Com isso, a placa tem seu tamanho aumentado e a solução fica com deficiência de cátions;
-
Uma ponte salina, formada por uma solução de água e cloreto de potássio (KCl), que possui cátions potássio (K+) e ânions cloreto (Cl-). Durante o funcionamento da pilha, cátions da ponte salina deslocam-se para a solução do cátodo, e os ânions da ponte salina deslocam-se para a solução do ânodo;
-
Um fio condutor conecta o ânodo ao cátodo.
Componentes de uma pilha qualquer
-
Ânodo: é o polo da pilha que sofre o processo de oxidação, ou seja, aquele que perde os elétrons;
-
Cátodo: é o polo da pilha que sofre o processo de redução, ou seja, aquele que recebe os elétrons. Geralmente, apresenta uma mistura pastosa com íons capazes de sofrer redução;
Não pare agora... Tem mais depois da publicidade ;) -
Condutor de elétrons: é o material por onde os elétrons percorrem o caminho do ânodo até o cátodo.
Exemplos de pilhas existentes no mercado
a) Pilha comum (pilha de Leclanché)
Foi a primeira pilha desenvolvida sem a presença de soluções. Trata-se de uma pilha capaz de produzir uma voltagem (diferença de potencial) em torno de 1,5 V e apresenta os seguintes componentes:
-
Ânodo: formado por uma placa de zinco metálico;
-
Cátodo: formado por uma pasta com dióxido de manganês (MnO2), cloreto de amônio (NH4Cl), água e amido.
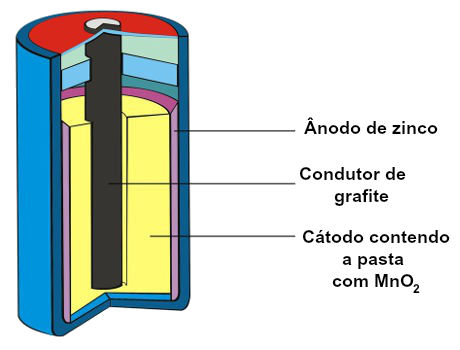
Representação esquemática dos componentes de uma pilha comum
Trata-se de uma pilha muito utilizada em brinquedos e dispositivos eletrônicos gerais (controle remoto, lanternas etc.).
b) Pilha alcalina
Trata-se de uma pilha que apresenta o mesmo padrão de estrutura da pilha comum. O diferencial está na composição do ânodo e do cátodo. É capaz de produzir uma voltagem em torno de 1,5 V e apresenta os seguintes componentes:
-
Ânodo: geralmente formado por uma placa de zinco, cádmio e outros metais;
-
Cátodo: formado também por uma mistura pastosa com óxidos de alguns metais, mas com a presença de cloreto de potássio (Kcl) em vez do cloreto de amônio.
Essa pilha apresenta as mesmas aplicações de uma pilha comum.
c) Pilha de lítio e iodo
Pilha alcalina capaz de produzir uma voltagem em torno de 2,8 V e apresenta os seguintes componentes:
-
Ânodo: formado por uma placa de lítio;
-
Cátodo: formado por um complexo de iodo.
Essa pilha é utilizada em aparelhos de marca-passo, por exemplo.
d) Pilha de mercúrio e zinco
Pilha alcalina capaz de produzir uma voltagem em torno de 1,35 V e apresenta os seguintes componentes:
-
Ânodo: formado por uma placa de zinco;
-
Cátodo: formado por uma pasta com óxido de mercúrio (HgO).
Essa pilha é muito utilizada em relógios e calculadoras, por exemplo.
* Créditos da imagem: Peter Gudella / Shutterstock
Aproveite para conferir nossas videoaulas sobre o assunto:








