Leis da radioatividade
As leis da radioatividade estudam a transmutação natural de um núcleo atômico quando emite partículas radioativas alfa ou beta.
Por Diogo Lopes Dias

PUBLICIDADE
As leis da radioatividade referem-se aos fenômenos nucleares estudados pelo químico inglês Frederick Soddy, com a co-autoria de Ernest Rutherford. Nessas leis, foi desvendado o comportamento dos núcleos atômicos durante a emissão de partículas radioativas.
As partículas radioativas que podem ser emitidas pelo núcleo de um átomo são alfa, beta e gama, as quais apresentam as seguintes características:
-
Alfa (2α4): formada por dois prótons e dois nêutrons;
-
Beta (-1β0): é um elétron;
-
Gama (0γ0): trata-se de uma onda eletromagnética.
Todas essas partículas são emitidas pelo núcleo de átomos radioativos (que apresentam instabilidade nuclear), assim, com exceção da radiação gama, de acordo com as leis da radioatividade propostas por Soddy, ao emitir radiação alfa ou beta, o átomo passa a ter uma nova carga nuclear (número atômico).
A partir do momento em que um átomo tem sua carga nuclear modificada, passa a ser um novo elemento químico. Assim, ao emitir radiações alfa ou beta, um átomo de um elemento sempre será transformado em um outro.
Com o estudo das leis da radioatividade, as chamadas transmutações nucleares (modificação do núcleo de um átomo) naturais passaram a ser conhecidas.
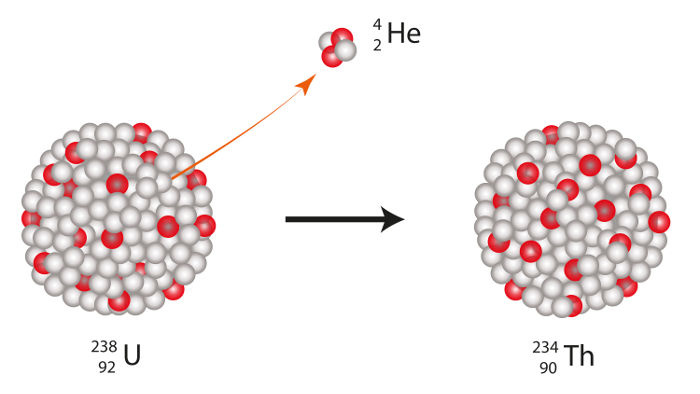
Representação da emissão de partícula alfa por um átomo de urânio
De acordo com Soddy, quando um átomo (X) emite uma partícula alfa de seu núcleo, forma-se um novo átomo (Y). Esse novo átomo formado possui número de massa quatro unidades menor, e o número atômico passa a ser duas unidades menor com relação ao átomo de origem.
A equação a seguir representa a primeira lei da radioatividade:
ZXA → 2α4 + Z-2YA-4
Se um átomo de tório-230 (90Th230) emitir uma partícula alfa, por exemplo, haverá a formação de um átomo de rádio (cujo número atômico é 88), com número de massa 226, conforme representado na equação:
90Th230 → 2α4 + 88Ra226
-
2ª lei da radioatividade
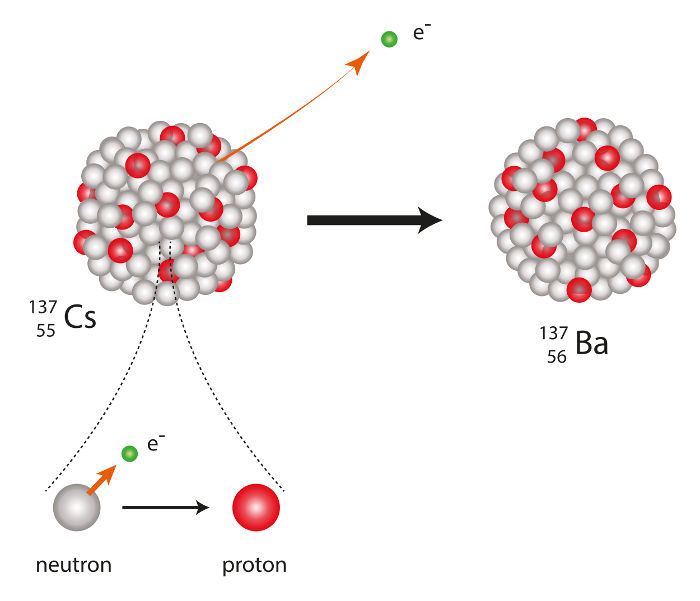
Representação da emissão de partícula beta por um átomo de césio
De acordo com Soddy, quando um átomo (A) emite uma partícula beta a partir do seu núcleo, forma-se um novo átomo (B). Esse novo átomo formado possui número de massa igual ao do átomo de origem, e o número atômico é uma unidade maior.
A equação seguinte representa a segunda lei da radioatividade:
ZAa → -1β0 + Z+1Ba
Obs.: O número de prótons no interior do núcleo do átomo aumenta com a emissão de uma partícula beta porque, de acordo com o físico italiano Enrico Fermi, um nêutron do núcleo sofre uma transmutação, formando um próton, um neutrino e um elétron (radiação beta).
1 0n1 → 1p1 + neutrino + -1β0
Se um átomo de carbono-14 (6C14) emitir uma partícula beta, por exemplo, haverá a formação de um átomo de nitrogênio (cujo número atômico é 7), com número de massa 14, como representado na equação:
6C14 → -1β0 + 7N14
* Créditos da imagem: Catwalker/ shutterstock
Aproveite para conferir nossa videoaula relacionada ao assunto: