NOX (número de oxidação)
O número de oxidação (NOX) é a carga que um elemento adquire ao estabelecer uma ligação química. Alguns elementos têm NOX fixo; em outros, o NOX depende da substância formada.
Por Stéfano Araújo Novais

PUBLICIDADE
O NOX (ou número de oxidação) é a carga que um elemento adquire ao estabelecer uma ligação química. Quando a ligação é de natureza iônica, o NOX é igual à carga do íon, enquanto quando a ligação é covalente, o NOX é igual ao número de ligações necessárias para estabilizar. Em substâncias simples e neutras o NOX do elemento é igual a zero.
O NOX de elementos em substâncias compostas pode ser calculado facilmente por algumas regras. Contudo, deve-se atentar para alguns elementos que, independentemente da substância formada, adquirem sempre a mesma carga, as chamadas substâncias de NOX fixo.
Leia também: Oxidorredução — processo identificado pela alteração do número de oxidação
Resumo sobre NOX (número de oxidação)
- O NOX, ou número de oxidação, representa a carga que um elemento adquire ao estabelecer uma ligação química.
- Em compostos iônicos, o NOX é igual à carga do íon.
- Em compostos covalentes, o NOX é igual ao número de ligações necessárias para estabilizar.
- Em substâncias simples e neutras, o NOX dos elementos é sempre igual a zero.
- Alguns elementos, independentemente da substância formada, adquirem sempre o mesmo NOX, sendo considerados elementos de NOX fixo.
- O cálculo do NOX em substâncias compostas é feito através do somatório do NOX dos elementos, sendo igual à carga total dessa substância.
Videoaula sobre número de oxidação (NOX)
O que é NOX?
NOX é um acrônimo para número de oxidação, que representa a carga que um elemento adquire ao estabelecer uma ligação química.
NOX dos elementos
Em compostos iônicos, em que a carga é definitiva, o NOX dos elementos é igual às cargas do ânion ou do cátion. Por exemplo, no CaBr2, para formação do composto, entende-se que cada átomo de cálcio perde dois elétrons, tornando-se o cátion Ca2+. Assim sendo, o NOX do cálcio é igual a +2. Entende-se, entretanto, que cada átomo de bromo recebe um único elétron, tornando-se o ânion Br−. Assim sendo, o NOX do bromo é igual a -1.
Já em compostos covalentes, onde há apenas compartilhamento de elétrons (sem formação de íons), o NOX do elemento é igual ao número de ligações covalentes estabelecidas até sua estabilidade. A carga, entretanto, será definida a partir da eletronegatividade dos átomos presentes na substância.
Ex.: No CO2, cada átomo de carbono faz quatro ligações covalentes para adquirir estabilidade, enquanto cada átomo de oxigênio faz duas ligações covalentes para adquirir estabilidade (O=C=O). Contudo, o carbono possui uma eletronegatividade menor que o oxigênio (ENC = 2,5; ENO = 3,5), assim o NOX para o carbono é +4 e para o oxigênio é -2.
Quando se trata de uma substância covalente simples, em que não há diferença de eletronegatividade (visto que só há um elemento químico), considera-se que os elementos participantes possuem NOX igual a 0.
Ex.: No H2, o NOX de cada átomo de hidrogênio é igual a 0.
Veja também: Como ocorrem as ligações de hidrogênio
Tabela de NOX
Alguns elementos químicos, independentemente dos compostos em que se encontram, sempre irão adquirir a mesma carga, sendo conhecidos como elementos de NOX fixo. Tais elementos estão listados na tabela a seguir.
|
Elementos de NOX fixo |
NOX |
|
Metais alcalinos (Li, Na, K, Rb, Cs, Fr) |
+1 |
|
Metais alcalinoterrosos (Be, Mg, Ca, Sr, Ba, Ra) |
+2 |
|
Flúor (F) |
−1 |
|
Alumínio (Al) |
+3 |
|
Zinco (Zn) |
+2 |
|
Cádmio (Cd) |
+2 |
|
Prata (Ag) |
+1 |
Alguns elementos possuem a particularidade de, na maioria dos casos, adquirirem a mesma carga. Entretanto, não é possível considerar que possuem NOX fixo. Um deles, o oxigênio, na maioria das vezes apresentará NOX igual -2, a menos que esteja ligado ao flúor (OF2 e O2F2), em peróxidos ou superóxidos.
Já o hidrogênio quase sempre terá a carga igual a +1, tendo carga igual a -1 em alguns compostos da classe dos hidretos (compostos binários de hidrogênio). Os demais halogênios (Cl, Br e I) apresentarão NOX igual a -1 se forem o elemento mais eletronegativo da substância. O mesmo ocorrerá com o enxofre, o qual terá carga igual a -2 se for o elemento mais eletronegativo da substância.
|
Elementos |
Caso |
NOX |
|
Oxigênio (O) |
Em geral |
-2 |
|
Com flúor |
OF2, NOXO = +2; O2F2, NOXO = +1 |
|
|
Peróxidos |
-1 |
|
|
Superóxidos |
-1/2 |
|
|
Hidrogênio (H) |
Em geral |
+1 |
|
Hidretos |
-1 |
|
|
Halogênios (Cl, Br e I) |
Se forem os mais eletronegativos |
-1 |
|
Enxofre (S) |
Se for o mais eletronegativo |
-2 |
Regras do NOX
Algumas regras são estabelecidas para que o NOX possa ser determinado corretamente, além do que já foi exposto.
- Em substâncias simples, o NOX dos elementos é sempre igual a zero.
- O NOX de um íon é igual a sua carga.
- Em substâncias compostas neutras, o somatório do NOX dos elementos é igual a zero.
- Em um íon composto (poliatômico), o somatório do NOX dos elementos é igual à carga total.

Como calcular o NOX?
Para calcular o NOX de um elemento, deve-se utilizar as regras do NOX, bem como a tabela de NOX fixos.
- Exemplo 1: Como calcular o NOX do enxofre (S) no K2SO4?
Sendo uma substância composta e neutra, o NOX do enxofre pode ser calculado pela seguinte expressão:
2.NOXK + NOXS + 4.NOXO = 0
O potássio é um metal alcalino, enquanto o oxigênio, nesse caso, tem NOX igual a -2.
2(+1) + NOXS + 4(−2) = 0
+ 2 + NOXS − 8 = 0
NOXS – 6 = 0
NOXS = +6
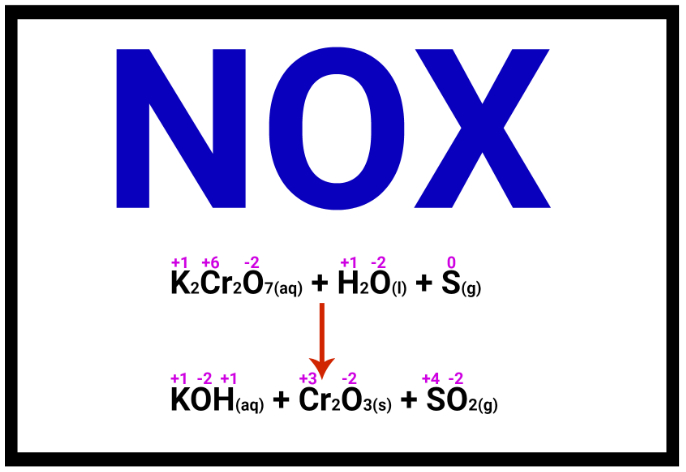
- Exemplo 2: Como calcular o NOX do cromo (Cr) no Cr2O72−?
Sendo um íon composto, O NOX do cromo pode ser calculado por meio da equação:
2.NOXCr + 7.NOXO = −2
2.NOXCr + 7(−2) = −2
2.NOXCr – 14 = −2
2.NOXCr = +12
NOXCr = +6
Saiba mais: Como ocorre uma ligação iônica
Exercícios resolvidos sobre NOX (número de oxidação)
Questão 1. (Uerj/2024) Recentemente, a Marinha do Brasil afundou no mar um porta-aviões deteriorado. Ambientalistas criticaram a operação, pois a estrutura do navio continha amianto, fibra mineral nociva à saúde. O principal componente do amianto é a substância de fórmula química Mg3Si2O5(OH)4.
Nessa substância, o número de oxidação do silício é igual a:
(A) -6.
(B) -4.
(C) +4.
(D) +6.
Resposta: Letra C.
Para calcular esse NOX do silício montamos a seguinte expressão:
3.NOXMg + 2.NOXSi + 5.NOXO + 4.(NOXO + NOXH) = 0
Aplicando os valores fixos de NOX, temos:
3.(+2) + 2.NOXSi + 5.(−2) + 4.(−2 + 1) = 0
2.NOXSi + 6 – 10 – 4 = 0
2.NOXSi – 8 = 0
2.NOXSi = +8
NOXSi +4
Questão 2. (USS Univassouras Medicina/2023.2) Uma solução aquosa utilizada na desinfecção de frutas e verduras é formada a partir da reação entre cloro molecular e água, representada pela seguinte equação química:
Cl2 (g) + H2O (l) → HCl (aq) + HClO (aq)
Dentre os produtos formados nessa reação, o maior número de oxidação do cloro corresponde a:
(A) +1.
(B) +2.
(C) +3.
(D) +4.
Resposta: Letra A.
Cálculo do NOXCl nas duas espécies formadas (produtos):
HCl → NOXH + NOXCl = 0 → +1 + NOXCl = 0 → NOXCl = −1
HClO → NOXH + NOXCl + NOXO = 0 → +1 + NOXCl – 2 = 0 → NOXCl = +1
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
DO CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.
INTERNATIONAL OF PURE AND APPLIED CHEMISTRY – IUPAC. Compendium of Chemical Terminology – IUPAC Recommendations (Gold Book). Disponível em: https://goldbook.iupac.org/