Cálculo estequiométrico com mol
O cálculo estequiométrico com mol tem como base a lei de Proust e o balanceamento de equações para determinar a quantidade de mol de qualquer membro da reação.
Por Diogo Lopes Dias
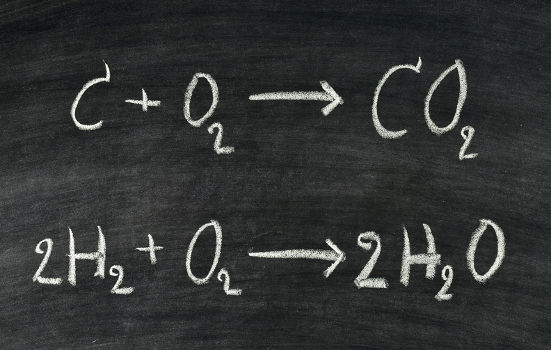
PUBLICIDADE
O cálculo estequiométrico com mol é uma forma de determinar a quantidade de matéria (mol) que deverá ser utilizada de um reagente ou que será formada em um ou em todos os produtos.
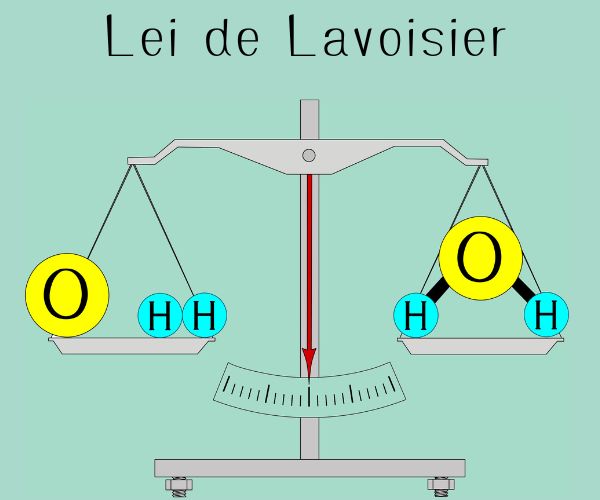
O cálculo estequiométrico com mol baseia-se em leis importantes da Química, como a lei de Proust, que diz que, em uma reação química, a divisão de números de mol ou massa dos participantes de uma reação resulta sempre em um valor constante.
Veja a reação de combustão do butano:
1 C4H10 + 13/2 O2 → 4 CO2 + 5 H2O
Nessa reação, 1 mol de butano reage com 6,5 mol de gás oxigênio, formando 4 mol de gás carbônico e 5 mol de água, de acordo com o balanceamento da equação.
Se fizermos essa reação na prática, colocando 4 mol de butano para reagir com 26 mol de gás oxigênio e formarmos 16 mol de gás carbônico e 20 mol de água, estaremos realizando uma reação química com quantidades de matéria (número de mol) que obedecem à lei de Proust, já que a divisão entre os coeficientes (mol) da equação e o número de mol sempre resulta em 0,25.
1 C4H10 + 13/2 O2 → 4 CO2 + 5 H2O
1 = 13/2 = 4 = 5
4 26 16 20
Utilizando o princípio demonstrado acima, poderíamos, por exemplo, descobrir a quantidade em mol de água que seria formada se utilizássemos 200 mol de butano em uma reação. Para tal, bastaria utilizar uma regra de três simples como a esquematizada a seguir:
1 C4H10 + 13/2 O2 → 4 CO2 + 5 H2O
1 C4H10 → 5 H2O
1 mol de butano--------5 mol de água
200 mol de butano----------x
x = 5.200
x = 1000 mol de água
Utilizando a lei de Proust, teríamos:
1 C4H10 → 5 H2O
1 = 5
200 x
x = 200.5
x = 1000 mol de água
Particularidades do cálculo estequiométrico com mol
A realização de cálculos estequiométricos envolve os seguintes conhecimentos:
-
Domínio da lei de Proust (clique aqui e relembre);
-
Domínio do balanceamento de equações químicas (clique aqui e relembre);
-
Capacidade de associar os coeficientes do balanceamento de qualquer equação às suas respectivas quantidades em mol;
-
Domínio sobre a construção de uma regra de três simples.
Exemplos
1º - (Unitau-SP) Na combustão do ciclexano (C6H12), qual é a quantidade em mol de oxigênio consumida para um mol de ciclexano queimado?
a) 6
b) 9
c) 12
d) 15
e) 18
Resolução:
Os dados fornecidos pelo exercício são:
-
número de mol do gás oxigênio = ?
-
número de mol do ciclexano = 1 mol
Passo 1: Montar e balancear a equação da reação descrita no exercício:
1 C6H12 + 9 O2 → 6 CO2 + 6 H2O
Passo 2: Calcular o número de mol do gás oxigênio O2.
Para isso, devemos construir uma regra de três simples em que, na primeira linha, teremos os números de mol referentes aos coeficientes do balanceamento e, na segunda linha, o número de mol do reagente fornecido pelo enunciado e a incógnita:
1 C6H12 + 9 O2 → 6 CO2 + 6 H2O
1 C6H12 → 9 O2
1 mol de ciclexano ------- 9 mol de gás oxigênio
1 mol ciclexano------------- x
x = 9 mol de gás carbônico
2º - (PUC-Camp) A combustão completa do metanol pode ser representada pela equação:
CH3OH(l) + O2(g) → CO2(g) + H2O(l)
Quando se utilizam 5,0 mol de metanol nessa reação, quantos mols de CO2 são produzidos?
a) 1,0
b) 2,5
c) 5,0
d) 7,5
e) 10
Resolução:
Dados fornecidos pelo exercício:
-
no de mol do O2: ?
-
no de mol do CO2: 5 mol
1a Etapa: verificar se a equação está balanceada.
Como a equação fornecida já está balanceada, temos um mol de cada um dos participantes.
1 CH3OH(l) + 1 O2(g) → 1 CO2(g) + 1 H2O(l)
2a Etapa: calcular o número de mol do gás carbônico CO2.
Para isso, devemos montar uma regra de três simples em que, na primeira linha, teremos os números de mol referentes aos coeficientes do balanceamento e, na segunda linha, a soma do número de mol dos reagentes e a incógnita:
1 CH3OH(l) + 1 O2(g) → 1 CO2(g) + 1 H2O(l)
CH3OH(l) → 1 CO2(g)
1 mol de metanol ------- 1 mol de gás carbônico
5 mol de metanol------------- x
x = 5 mol de gás carbônico
3º - (Acafe-SC) Considere a equação química não balanceada da combustão do butano, gás combustível utilizado em isqueiros, representada por
C4H10 + O2 → CO2 + H2O.
O número de mols de gás oxigênio usado na combustão total de 2 mols de butano é:
a) 13/2
b) 13
c) 8
d) 5
e) 16
Resolução:
Dados fornecidos pelo exercício:
-
no de mol do O2: ?
-
no de mol do butano: 2 mol
1a Etapa: Como a equação fornecida não está balanceada, devemos balanceá-la. Os coeficientes que a tornam balanceada são:
C4H10 + 13/2O2 → 4 CO2 + 5 H2O
2a Etapa: Calcular o número de mol do gás carbônico CO2.
Para isso, devemos montar uma regra de três simples em que, na primeira linha, teremos os números de mol referentes aos coeficientes do balanceamento e, na segunda linha, a soma do número de mol dos reagentes e a incógnita:
C4H10 + 13/2O2 → 4 CO2 + 5 H2O
C4H10 → 13/2O2
1 mol de butano ------- 6,5 mol de gás oxigênio
2 mol de butano------------- x
x = 2.6,5 mol
x = 13 mol de gás oxigênio
Por Me. Diogo Lopes Dias
Videoaulas relacionadas: