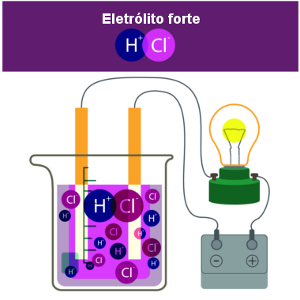
Titulação
A titulação é uma técnica utilizada para determinar a concentração de uma substância em uma solução, através da reação controlada com uma solução de concentração conhecida.
Por Jhonilson Pereira Gonçalves

PUBLICIDADE
A titulação é uma técnica usada para a determinação da concentração desconhecida em uma solução. Para isso, uma solução de concentração conhecida, denominada titulante, é gradualmente adicionada a uma solução, cuja concentração se desconhece, denominada titulado, até que a reação química entre eles seja completa.
Diante disso, essa técnica pode ser aplicada em diversos contextos, como na determinação da acidez ou alcalinidade de uma solução, na análise da pureza de substâncias químicas, bem como no controle de qualidade de processos industriais. Por isso, existem diferentes tipos de titulação, como a titulação ácido-base, na qual se determina a concentração de ácidos ou bases em uma solução; a titulação redox, que envolve reações de oxidação-redução; e a titulação de precipitação, usada para medir a concentração de íons que formam um precipitado sob certas condições.
Leia também: Solubilidade — o que é e como ocorre?
Resumo sobre titulação
- Titulação é um método usado para determinar a concentração de uma substância em uma solução.
- Envolve a reação controlada entre uma solução de concentração conhecida (titulante) e uma solução da substância a ser analisada (titulado).
- Um indicador é frequentemente usado para indicar o ponto final da titulação.
- Os cálculos da titulação são baseados na estequiometria da reação entre o titulante e o titulado.
- Existem vários tipos de titulação, incluindo ácido-base, complexação, oxirredução e precipitação.
- A titulação é amplamente utilizada em laboratórios para análises químicas precisas.
Videoaula sobre titulação
O que é titulação?
A titulação é uma técnica analítica quantitativa, ou seja, é utilizada para determinar a concentração desconhecida de uma substância de interesse (analito) em determinada solução. Nesse processo, ocorre a participação de três componentes que caracterizam essa técnica:
- o titulante (solução de concentração conhecida);
- o titulado (solução de concentração desconhecida);
- o agente indicador – substância que muda de cor ou forma precipitados.
Nesse contexto, é importante diferenciarmos dois conceitos, que são: ponto de equivalência e ponto final. O ponto de equivalência marca o momento em que a reação alcança a sua conclusão, isto é, o ponto ideal em que a quantidade de titulante adicionada é suficiente para reagir completamente com a quantidade do analito presente na solução.
Já o ponto final da titulação é o momento em que se observa uma mudança detectável que indica que a reação entre o titulante e o titulado está completa. Isso geralmente é indicado por uma mudança de cor quando se usa um indicador apropriado. Portanto, nem sempre ambos coincidem.
Como é o processo de titulação?
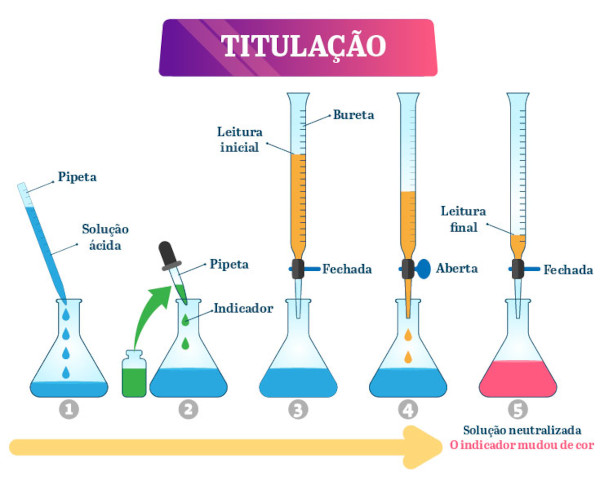
O processo de titulação se divide em etapas e cada uma necessita de cuidados por parte do analista. Isso ajuda a evitar erros no preparo das soluções, na calibração de equipamentos e na aferição das vidrarias que possam induzir à interpretação errada dos resultados. Portanto, as etapas da titulação seguem da seguinte forma:
- Preparação das soluções: deve ser preparada uma solução padrão de concentração conhecida (titulante) e a solução da substância a ser analisada (titulado).
- Calibração da bureta: a solução do titulante é adicionada na bureta para ser gotejada na solução que será titulada (certifique-se de calibrá-la corretamente e ler o volume com precisão).
- Adição do indicador: o indicador apropriado terá algumas gotas adicionadas à solução a ser titulada, geralmente em um erlenmeyer, e ao mudar de cor significa que ponto de equivalência da reação foi alcançado, caracterizando o fim da titulação.
- Titulação: o titulante é adicionado gota a gota à solução titulada, agitando-a continuamente e lentamente para evitar o excesso e não passar do ponto de equivalência (não queremos isso), o qual é atingido quando a quantidade correta de titulante reagir completamente com o titulado. Logo, qualquer mudança de cor na solução deve ser observada, pois sinaliza que a reação entre eles está completa.
Veja na imagem abaixo o resumo dessas etapas:
Diante disso, ao final da titulação, resta uma das etapas mais importantes para que a finalidade da técnica seja cumprida: o cálculo da concentração. Uma vez com os dados do volume do titulante gasto no processo, é possível determinar a concentração do titulado.
Veja também: Vidrarias mais utilizadas em laboratórios — nomes e funções
Quais são os tipos de titulação?
Existem vários tipos de titulação, cada uma adequada para determinar a concentração de diferentes tipos de substâncias. Em vista disso, o princípio que fundamenta todas elas é: determinação de uma concentração desconhecida. Veja o quadro exemplificativo abaixo em que falamos de cada uma delas:
|
Tipo de titulação |
Determinação da concentração |
|
Ácido-base |
Ácidos ou bases em uma solução. Ex.: determinar a concentração de ácido clorídrico em uma solução aquosa; uma base forte, como hidróxido de sódio, é usada como titulante. |
|
Complexação |
Íons metálicos que formam complexos estáveis. Ex.: titulação de EDTA (ácido etilenodiaminotetracético) com cálcio ou magnésio. |
|
Agentes redutores ou oxidantes em uma solução. Ex.: titulação de permanganato de potássio com ferro (II) em meio ácido; o permanganato é o oxidante e o ferro (II) é o redutor. |
|
|
Precipitação |
Íon que forma um precipitado insolúvel com um íon específico. Ex.: titulação de cloreto de sódio com nitrato de prata para determinar a concentração de cloreto na solução. |
→ Titulação ácido-base
Na titulação ácido-base, podemos determinar tanto a concentração de uma substância ácida ou básica (titulado), isso vai depender da análise de interesse. Desse modo, caso o analito de interesse seja um ácido, o titulante será uma base, e o contrário também é válido. Sendo assim, vejamos o que é necessário para realizar uma titulação desse tipo:
- Equipamentos e reagentes para titulação ácido-base:
- Bureta: utilizada para adicionar o titulante à solução titulada.
- Erlenmeyer ou balão volumétrico: onde a solução titulada é colocada.
- Pipeta: para medir com precisão o volume da solução que será titulada.
- Indicador ácido-base: fenolftaleína ou azul de bromotimol.
- Ácido ou base padrão de concentração conhecida: o titulante.
- Solução do ácido ou base a ser determinada: a solução titulada.
- Procedimento da titulação ácido-base:
- Preparação das soluções: prepare o titulante de concentração conhecida e a solução do ácido ou base a ser determinado. Certifique-se de que ambos os reagentes estejam em temperatura ambiente.
- Calibração da bureta: encha a bureta com o titulante e certifique-se de que não há bolhas de ar. Registre o volume inicial da bureta.
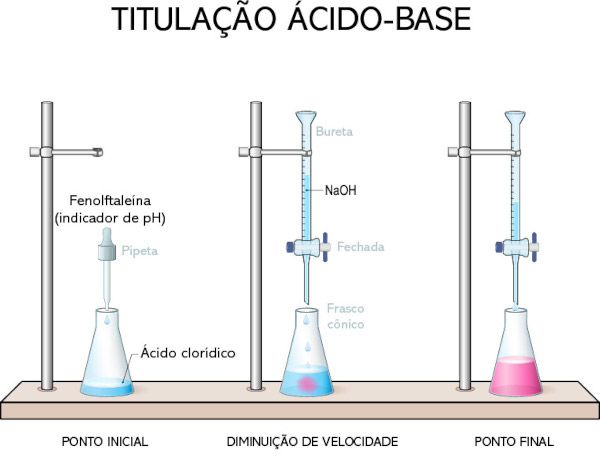
- Adição do indicador: adicione algumas gotas do indicador à solução a ser titulada. A escolha do indicador depende do pH inicial da solução. Por exemplo, a fenolftaleína é adequada para soluções ácidas, enquanto o azul de bromotimol é usado para soluções básicas.
- Titulação: comece a adicionar o titulante à solução titulada, agitando continuamente. A adição deve ser lenta, especialmente perto do ponto final da titulação. O ponto final é atingido quando a mudança de cor do indicador é observada. Por exemplo, a fenolftaleína muda de incolor para rosa em soluções básicas, conforme é mostrado na imagem abaixo:

- Registro do volume de titulante: anote o volume de titulante usado na titulação. Isso é importante para calcular a concentração da solução titulada.
Cálculos da titulação
Com base no volume do titulante utilizado, é possível calcular a concentração do analito no titulado. Isso é feito usando a estequiometria da reação entre o titulante e o titulado. Mas para entendermos melhor, vamos levar em consideração um exemplo bastante comum nos laboratórios de ensino e pesquisa, que é a titulação ácido-base (citada no tópico anterior), na qual geralmente utiliza-se uma base de concentração conhecida, nesse caso NaOH, para titular um ácido, HCl, cuja concentração não se sabe.
Exemplo:
Numa titulação ácido-base de HCl, cujo procedimento está ilustrado na imagem abaixo, foram consumidos 12,6 mL de NaOH a 0,1 mol/L. Determine a concentração do ácido, sabendo que no início da titulação havia 25 mL de HCl no erlenmeyer.
Primeiro devemos determinar a estequiometria da reação:

Perceba que a reação de neutralização acontece em uma proporção de 1:1, ou seja, é necessário 1 mol de NaOH para reagir com 1 mol de HCl.
Sendo assim, podemos dizer que:
n1 = n2
Entenda como “n” sendo número de mols, logo:
n1 = nº de mols do NaOH
n2 = nº de mols do HCl
Agora façamos os cálculos de quantos mols de cada um realmente participaram da reação. Para isso usamos a expressão da molaridade:
\(M = \frac{n}{v}\)
M = concentração molar
v = volume
Dessa forma, fazendo meio pelos extremos, temos a seguinte expressão: NaOH
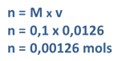
Portanto, se o número de mols de NaOH que participaram da reação é 0,00126, por analogia temos HCl também igual a 0,00126 mols, já que a proporção da reação foi de 1:1, sendo n1 = n2.
Por fim, podemos calcular a concentração de ácido presente na amostra usando a expressão anterior da concentração molar: HCl
n = 0,00126 mols
v = 25 mL = 0,025 L
\(M = \frac nv\)
M = \(\frac{0,00126} {0,025}\) → M = 0,05 mol/L
Então, veja que nessa titulação hipotética a concentração de ácido clorídrico (antes desconhecida) é 0,05 mol/L. Ou de uma forma mais direta, podemos usar a mesma expressão da diluição para chegarmos ao mesmo resultado:
n1 = n2
ou
M1 x V1 = M2 x V2
M2 = \(\frac{M1xV1}{V2}\)
M = \(\frac{0,1x0,0126}{0,025}\) → M = 0,05 mol/L
Saiba mais: Como fazer cálculos que envolvem solubilidade
Exercícios resolvidos sobre titulação
1) (Cederj) O ácido fumárico é um composto orgânico usado, com muita frequência, pela indústria de alimentos por ser um acidulante que ajuda a prolongar o prazo de validade dos produtos. É comum encontrá-lo em refrigerantes, sucos e geleias. Ele é um ácido dicarboxílico, insaturado, de cadeia normal, também conhecido como ácido donítico, cuja fórmula estrutural é:
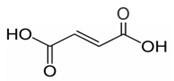
Sabendo que na titulação de 30,00 mL de solução desse ácido foram gastos 60,00 mL de NaOH 0,120 mol/L, sua molaridade em mol/L é
A) 0,060
B) 0,120
C) 0,240
D) 0,360
Gabarito: B
Perceba que na molécula de ácido fumárico há dois grupos carboxílicos que fornecerão dois hidrogênios ionizáveis (H+) para a solução. Logo, serão necessárias duas hidroxilas (OH-) para neutralizá-los, sendo a estequiometria da reação de forma simplificada de 1:2.
1 mol do ácido + 2 mols de NaOH
Sendo assim, calculemos primeiro o número mols de NaOH que reagiram:
Obs.: Converta os volumes em mL para litros: 60 mL = 0,06 L; 30 mL = 0,03 L
n = M x v → n = 0,120 x 0,06 → n = 0,0072 mols de NaOH reagiram com o ácido.
Então, se pela equação balanceada temos a proporção de 1:2, significa que o número mols de NaOH é o dobro de mols de ácido: nácido = 2nNaOH. Logo, para o ácido teremos metade do valor encontrado para NaOH.
nácido = 0,0072/2 → nácido = 0,0036
Portanto, a concentração do ácido na amostra é:
M = n/V → M = 0,0036/0,03 → M = 0,12
2) Em um laboratório de química, um estudante realiza uma titulação ácido-base para determinar a concentração de uma solução de ácido clorídrico (HCl). O estudante usa uma solução de hidróxido de sódio (NaOH) 0,1 M como titulante e fenolftaleína como indicador. Durante a titulação, o ponto final é atingido quando a solução titulada muda de incolor para rosa claro após ele adicionar 20,0 mL de NaOH a 25,0 mL de HCl. Diante disso, qual é a concentração do ácido clorídrico em mol/L?
A) 0,020
B) 0,100
C) 0,125
D) 0,500
E) 0,080
Gabarito: E
Convertendo os volumes para litros, temos: 0,025 L de HCl e 0,020 L de NaOH. Em vista disso, determinemos a estequiometria da reação pela equação balanceada:
1 HCl + 1 NaOH à 1 NaCl + 1 H2O
Portanto, temos a proporção de 1:1 entre HCl e NaOH. Logo, basta aplicar os valores fornecidos na expressão: M1 x V1 = M2 x V2, ou melhor, Ma x Va = Mb x Vb.
Ma x 0,025 = 0,020 x 0,1 → Ma = (0,020 x 0,1) / 0,025
Ma = 0,0020 / 0,025
Ma= 0,08 mol/L
Créditos da imagem
Fontes
ANDRADE, J. C. DE. Química analítica básica. Revista Chemkeys, v. 3, p. e021002, 5 ago. 2021.
ATKINS, P.; JONES, L. Titulações. In: Pricípios de Química: Questionando a vida moderna e o meio ambiente. 5. ed. [s.l.] Bookman, 2012. p. 483–494.
SKOOG, D. A. et al. Métodos Titulométricos; Titulometria de Precipitação. In: Fundamentos de Química Analítica. 8. ed. [s.l.] Thomson, 1967. p. 321–325.