Metais
Os metais são uma classe de substâncias químicas que apresentam brilho característico, além de boa condutividade térmica e elétrica.
Por Stéfano Araújo Novais

PUBLICIDADE
Os metais são uma classe de substâncias químicas que possuem como principais características a condutividade elétrica, condutividade térmica, além de brilho característico, ductilidade e maleabilidade. Quimicamente, os metais demonstram baixa energia de ionização e podem ser vistos como elementos eletropositivos. Os metais são maioria na Tabela Periódica, existindo cerca de 90 elementos metálicos.
Os metais são divididos em diversos tipos, sendo que alguns são mais difundidos no nosso cotidiano, como a classe dos metais nobres e pesados, e outros são mais de cunho acadêmico, como os metais alcalinos e ferromagnéticos. Os metais tiveram origem no Big Bang e acabam sendo a base da formação de nosso planeta. Por isso, há muito tempo exploramos essas substâncias, as quais têm grande importância para diversos setores da indústria.
Leia também: O que são as ligas metálicas?
Resumo sobre os metais
- Metais são uma classe de substâncias que são caracterizadas por propriedades específicas, como condutividade térmica e elétrica, além de brilho característico.
- Os metais são também materiais dúcteis e maleáveis.
- Quimicamente demonstram baixa energia de ionização e são caracterizados como eletropositivos.
- Existem cerca de 90 elementos metálicos na Tabela Periódica, consistindo na maioria dos elementos presentes nela.
- É possível dividir os metais em diversos tipos, entre os tipos mais comuns estão os metais nobres e metais pesados.
- A ligação entre átomos metálicos é mais bem explicada pela teoria do orbital molecular, que requer conhecimento de Mecânica Quântica. Contudo, a primeira teoria, do mar de elétrons, é ainda muito utilizada para fins didáticos.
- Gerados no Big Bang, os metais têm grande importância e aplicação, sendo aplicados na confecção de ligas, dispositivos eletrônicos e utensílios diversos do nosso cotidiano.
Videoaula sobre os metais
O que são metais?
Metais são uma classe de substâncias que é caracterizada pela boa condutividade elétrica e térmica, além da maleabilidade e ductilidade, e por um brilho característico, consequência direta da alta refletividade da luz.
Características e propriedades dos metais
Os metais possuem características e propriedades físicas e químicas bem definidas, o que auxilia na sua identificação e compreensão.
Em primeiro lugar, o que mais chama atenção nos metais é o seu brilho característico, que é consequência da reflexão da luz incidida sobre o material. A luz é uma radiação eletromagnética que, ao incidir sobre a superfície metálica, faz com que os elétrons oscilem, reemitindo a luz incidente. Os elétrons, inclusive, oscilam em sintonia com a luz incidente e, assim, geram luz na mesma frequência. Em termos mais simples, uma luz de cor vermelha que incide sobre um metal será refletida como uma luz vermelha. É por isso que uma imagem no espelho, que possui um pequeno revestimento metálico no vidro, é uma representação fiel do objeto.
A mobilidade eletrônica dos metais também pode explicar duas outras propriedades dos metais: a ductilidade e a maleabilidade. A ductilidade é a capacidade de se deformar um material sem seu rompimento, o que permite a criação de fios metálicos, e a maleabilidade permite ao metal ser facilmente dobrado, laminado, forjado e conformado. Os átomos de metal, em fase sólida, formam uma estrutura compacta que é formada por meio da junção de diversas camadas de átomos metálicos. Essas camadas podem deslizar umas sobre as outras mediante estresse mecânico (como uma pancada de um martelo), deformando assim o material. Os metais podem se solidificar com estruturas compactas diferentes, sendo assim existem algumas estruturas que apresentarão camadas mais fáceis de deslizar umas sobre as outras, enquanto outras não. Assim, quanto mais fácil o deslizamento das camadas, mais maleável é o metal. Do contrário, ele tende a ser mais quebradiço.

Duas propriedades físicas de extrema importância dos metais são a condutividade térmica e elétrica, também consequência da mobilidade eletrônica em sua estrutura. Apresentam, de forma geral, alto ponto de fusão e ebulição, além de alta densidade.
Do ponto de vista químico, os metais são caracterizados por uma baixa energia de ionização, que é a energia necessária para retirar um elétron da camada de valência de um átomo isolado no estado gasoso. Por isso, é comum dizer que os metais perdem elétrons com relativa facilidade.
Metais na Tabela Periódica
O número total de metais na Tabela Periódica varia um pouco, muito por conta das propriedades de alguns elementos superpesados recém-descobertos, bem como a questão dos metaloides (ou semimetais), os quais possuem propriedades comuns com metais e ametais.
A American Chemical Society, em sua Tabela Periódica oficial em que constam os 118 elementos descobertos até então, apresenta 91 espécies classificadas como metais e mais 7 sendo classificadas como metaloides. Autores indicam ainda que dos 90 elementos que ocorrem na natureza, 66 são metais. Embora o número exato seja tema de discussão, o fato é que os metais compõem a maioria dos elementos da Tabela Periódica.
Para saber mais detalhes sobre a Tabela Periódica, clique aqui.
Tipos de metais

Diversas são as classificações possíveis para os metais, algumas mais difundidas no cotidiano, outras nem tanto, sendo mais restritas ao mundo acadêmico.
- Metais alcalinos: compõem os metais do grupo 1 da Tabela Periódica, que são lítio, sódio, potássio, rubídio, césio e frâncio.
- Metais alcalino-terrosos: compõem os metais do grupo 2 da Tabela Periódica, que são berílio, magnésio, cálcio, estrôncio, bário e rádio.
- Metais de transição: são os metais que estão entre os grupos 3 e 12 da Tabela Periódica. Podem ainda ser subdivididos em metais de transição interna, que são os lantanídeos e actínideos, e os de transição externa, os quais são os demais metais desse bloco.
- Metais pesados: a definição de metal pesado não é algo unânime, mas boa parte dos autores busca definir em função da densidade. Para ser um metal pesado, a densidade do metal deve ser superior a 5 g/cm³.
- Metais essenciais: são metais importantes para o funcionamento dos sistemas orgânicos. Tais metais, quando presentes em alimentos, exercem papel biológico necessário para a manutenção da saúde humana e animal. Dentre os metais essenciais podemos citar cálcio, cobalto, cromo, cobre, estanho, ferro, magnésio, manganês, molibdênio, níquel, potássio, sódio e zinco.
- Metais nobres: embora sejam mais associados ao seu alto valor agregado, os metais nobres possuem uma excelente resistência à corrosão. Nesse grupo estão o ouro, a prata e os metais do grupo da platina, MGPs, que são platina, paládio, ródio, irídio, rutênio e ósmio. Por vezes, mercúrio e cobre também são incluídos como metais nobres.
- Metais ferromagnéticos: são metais que se imantam fortemente na presença de um ímã externo (campo magnético) e, assim sendo, são atraídos por ímãs naturais. O ferro, o níquel e o cobalto são exemplos de metais pertencentes a tal classe.
- Metais paramagnéticos: também se imantam na presença de um ímã externo, porém com muito menos intensidade que os ferromagnéticos e, por conta disso, são fracamente atraídos por ímãs, como é o caso do alumínio, da platina e do magnésio.
- Metais diamagnéticos: são metais que não são atraídos por ímãs externos, já que na presença de um campo magnético externo acabam estabelecendo um campo magnético contrário. É o caso do ouro, do cobre, da prata e do bismuto.
Ligações químicas dos metais
A ligação química estabelecida entre os metais começou a ser explicada na virada para o século XX, mais especificamente em 1900, por Paul Drude. O ponto teórico de partida para Drude foi a teoria cinética dos gases (TCG), um modelo microscópico acerca da matéria gasosa e que teve grande êxito.
A TCG descreve as propriedades dos gases tratando as moléculas gasosas como esferas sólidas idênticas, que se movimentam de forma retilínea e colidem elasticamente entre si. Além disso, estabelece que o tempo da colisão das moléculas é desprezível e que não há interação entre as moléculas gasosas, salvo quando colidem.
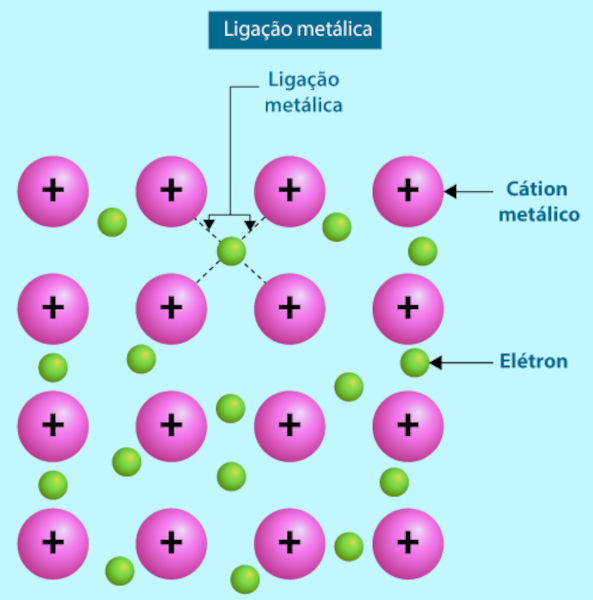
Drude, então, teorizou que quando os átomos metálicos se unissem para a ligação, os elétrons de valência (os quais estão fracamente ligados aos átomos, dada a baixa energia de ionização) sairiam e se moveriam livremente entre os cátions de metais, os quais permaneceriam praticamente fixos, em uma rede cristalina que ficou conhecida como “mar de elétrons”. Com o tempo, o modelo de Drude se mostrou obsoleto, pois era baseado em interpretações clássicas da Mecânica Estatística. O desenvolvimento da Mecânica Quântica trouxe, assim, um melhor entendimento da forma pelas quais os metais se ligam, por meio da teoria do orbital molecular e a formação de bandas de condução.
Contudo, o modelo de Drude é histórico, sendo considerado bastante ousado. Além do mais, consegue explicar com grande clareza a condutividade térmica e elétrica dos metais, por meio do fluxo de elétrons soltos na estrutura cristalina metálica. Por isso, é muito comum ser o primeiro contato dos alunos com a forma de ligação química entre metais.
Acesse também: O que é ligação metálica?
Origem dos metais
Os metais, como matéria, têm sua origem há bilhões de anos, na formação do nosso universo, através do Big Bang. Lá, prótons e nêutrons dispersos, formados quando o plasma de quarks e glúons se resfriou suficientemente, começam a se unir para a formação de elementos químicos, como hidrogênio (e seus isótopos) e hélio. Tais átomos leves continuam a se fundir, formando elementos mais pesados e, assim, os demais elementos que conhecemos.
O nosso planeta então foi formado a partir da poeira cósmica desse evento, justificando, assim, a presença dos mais diversos metais em nossa crosta. Os seres humanos começaram a explorar os metais por volta de 8000 a.C., mais especificamente o cobre, o que marcou o início da Era do Cobre, ou o Período Calcolítico.
Uso dos metais no cotidiano

A ampla utilização dos metais em nosso cotidiano demonstra a sua importância. Talvez a maior aplicação dessas substâncias seja na formação de ligas, que consistem na mistura de dois ou mais metais fundidos e que depois resfriam. As ligas têm larga utilização na indústria civil, automobilística e de transportes. Das ligas existentes, o aço (mistura de ferro com carbono), o bronze (cobre com estanho) e o latão (cobre com zinco) são as mais utilizadas.
Os metais podem ser, então, na forma bruta ou na forma de ligas. Dentre os principais setores econômicos e cotidianos em que vemos a utilização de metais temos:
- Joalherias: confecção de joias de forma geral, como brincos, cordões, braceletes, entre outras, além de relógios.
- Roupas: confecção utensílios para roupas, como fivelas de cinto, botões e zíperes.
- Eletroeletrônicos: partes de diversos aparelhos eletrônicos, como celulares, tablets e computadores portáteis. Também são utilizados na fabricação de conectores e fios elétricos.
- Eletrodomésticos: partes da estrutura e motores de eletrodomésticos como geladeiras, fogão, ares-condicionados, micro-ondas, entre outros.
- Próteses: utilização na confecção de próteses ortopédicas e dentais.
- Utensílios diversos: confecção de brinquedos, instrumentos de medição e de corte, como tesouras, foices e enxadas, instrumentos musicais, entre outros.
A importância comercial dos metais é grande. Segundo o Anuário Mineral Brasileiro de 2022, em 2021 o Brasil produziu quase 313 bilhões de reais com 11 substâncias metálicas, o que permitiu um ganho de 75,4 bilhões de dólares com exportações.
Metais x ametais
Os ametais possuem características contrárias a dos metais. Ou seja, dentro de uma classificação binária, ou você possui características de um metal, ou é um ametal. Algumas características antagônicas são postas na tabela a seguir.
|
Metais |
Ametais |
|
Possuem brilho característico |
Não possuem brilho característico |
|
Em geral, alto ponto de fusão e ebulição |
A maioria possui baixo ponto de fusão e ebulição |
|
Baixa energia de ionização |
Alta energia de ionização |
|
Baixa afinidade eletrônica |
Alta afinidade eletrônica |
|
Dúcteis e maleáveis |
Quebradiços |
|
Condutores elétricos e térmicos |
Isolantes térmicos e elétricos |
É claro que essa é uma avaliação ampla e geral, e obviamente podem ocorrer algumas exceções. Por exemplo, o carbono é um ametal, mas possui certo brilho, além de ser o elemento com maior ponto de fusão da Tabela Periódica. Já o mercúrio é um líquido em temperatura ambiente, enquanto o gálio se funde por volta dos 30 °C.
Exercícios resolvidos sobre metais
Questão 1
(Enem PPL) Um dos materiais mais antigos e ainda utilizados na restauração dos dentes são as amálgamas, um produto da combinação de mercúrio (Hg) com prata (Ag) e estanho (Sn), como apresenta a equação química:
24 Ag (s) + 8 Sn (s) + 37 Hg (l) → 12 Ag2Hg3 (s) + Sn8Hg (s)
Os materiais formados pelos elementos citados são caracterizados como
A) precipitados.
B) ligas metálicas.
C) compostos iônicos.
D) produtos de oxidação.
E) compostos covalentes.
Resolução:
Alternativa B.
Os materiais formados são substâncias compostas com átomos de metais apenas (prata, mercúrio e estanho). Assim sendo, configuram substâncias em que dois metais diferentes estão ligados, o que pode ser entendido como uma liga metálica.
Questão 2
(Unit) Os metais são caracterizados por sua ductilidade e maleabilidade. Enquanto a primeira propriedade está relacionada à capacidade de obter fios metálicos, a segunda propriedade diz respeito à facilidade de transformar os metais em fios. Para explicar essas características das substâncias metálicas, usa-se o modelo do mar de elétrons.
Sobre o fato de os metais serem maleáveis e dúcteis, com base no referido modelo, é correto afirmar:
A) O modelo do mar de elétrons é explicado pela teoria de Lewis.
B) Nos metais, os elétrons ficam deslocalizados, o que significa dizer que eles são transferidos de um átomo para outro.
C) Mesmo alterando a posição dos átomos, os elétrons deslocalizados são redistribuídos entre os vários átomos que se ligam nos metais.
D) Nos metais, os elétrons são compartilhados por todos os átomos que compõem o sólido, e essas partículas negativas se localizam a maior parte do tempo na região internuclear.
E) Os metais são formados por cátions submersos em um mar de elétrons, e o modelo do mar de elétrons não explica satisfatoriamente a maleabilidade e ductilidade dessas substâncias.
Resolução:
Alternativa C.
A maleabilidade e a ductilidade dos metais podem ser entendidas como consequência da mobilidade eletrônica. Após o impacto sobre a estrutura, como, por exemplo, por causa da ação de um martelo, as camadas dos átomos metálicos deslizam entre si. O material é deformado (e não quebrado), justamente porque os elétrons estão livres, permitindo se redistribuir facilmente e, assim, os átomos se movimentam com relativa facilidade. A ligação metálica não é muito direcionada, como é o caso da ligação covalente, por exemplo, o que também auxilia nesse fenômeno.
Fontes
AMERICAN CHEMICAL SOCIETY – ACS. Periodic Table of Chemical Elements. Disponível em: https://www.acs.org/education/whatischemistry/periodictable.html.
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
BRASIL, AGÊNCIA NACIONAL DE MINERAÇÃO. Anuário Mineral Brasileiro: principais substâncias metálicas. Brasília: ANM, 2022.
BRITANNICA. Noble Metal. Disponível em: https://www.britannica.com/science/noble-metal.
FILHO, M. S. A. Magnetismo. Disponível em: https://www.iag.usp.br/~agg110/moddata/GEOMAGNETISMO/AGG0110quintaAula2018.pdf2024.
HAMANN, C. R.; HAMANN, D. Metals in Everyday Life. In: Metal Allergy. Cham, Suíça: Springer, 2018.
INSTITUTO NACIONAL DO CANCER – INCA. Metais pesados, câncer e os riscos ambientais. Instituto Nacional do Câncer. Rio de Janeiro: INCA, 2024.
LIMA, V. F.; MERÇON, F. Metais Pesados no Ensino de Química. Química Nova Na Escola. v. 33, n. 4, nov. 2011.
MURR, L. E. A Brief History of Metals. In: Handbook of Materials Structures, Properties, Processing and Performance. Cham, Suíça: Springer, 2015.
PÉREZ, C. A. S. O modelo do elétron livre de Drude completa 100 anos. Caderno Catarinense de Ensino de Física. v. 17, n. 3, p. 348-359, dez. 2000.

















