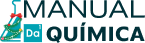Elétron
O elétron é uma partícula fundamental presente na estrutura atômica. Dotado de carga elétrica negativa, é importante para explicar efeitos associados à matéria.
Por Stéfano Araújo Novais
PUBLICIDADE
O elétron é uma partícula presente na estrutura do átomo e que possui carga elétrica negativa. Mais especificamente, os elétrons estão presentes na região da eletrosfera do átomo, uma região periférica ao redor do núcleo atômico.
Possuem uma massa de aproximadamente 9 x 10-31 kg, cujo valor é cerca de 1836 vezes menor que a massa do próton, e uma carga de -1,60 x 10-19 C. Essa partícula foi descoberta em 1897 pelo físico britânico Joseph John Thomson, por meio de experimentos com raios catódicos em uma ampola de Crookes.
Leia também: Átomo — a partícula base formadora de toda matéria
Resumo
-
Os elétrons são partículas fundamentais dotadas de carga elétrica negativa.
-
Estão localizados na eletrosfera, uma região periférica ao redor do núcleo atômico.
-
Possuem massa cerca de 1836 vezes menor que a do próton.
-
Foram descobertos por Joseph John Thomson, em 1897.
-
São os responsáveis pelos efeitos de condutividade elétrica e térmica dos materiais.
-
São os responsáveis pelo estabelecimento de ligações químicas entre os átomos.
O que é o elétron?
A descoberta do elétron é atribuída ao físico britânio Joseph John Thomson, depois da publicação de um artigo científico, em 1897, em que ele tratava de diversas medidas acerca dos raios catódicos. Esses raios, descobertos pelo matemático e físico Julius Plücker e percebidos também por William Crookes, surgiam quando se passava uma corrente elétrica em um gás rarefeito dentro de um recipiente.
Thomson já sabia que esses raios catódicos, termo cunhado por Eugen Goldstein, eram compostos por partículas negativas, mas seus estudos elucidaram importantes aspectos sobre as características constituintes dos raios catódicos, como a razão entre a carga e a massa. Não só isso, mesmo mudando o gás e outras substâncias do experimento, Thomson chegava sempre à mesma relação entre a carga e a massa, indicando que ele estava diante de uma partícula universal (presente em todos os elementos químicos), de carga gigantesca e massa ínfima.
Inicialmente essa partícula foi chamada por Thomson de corpúsculo, mas, posteriormente, de elétron.
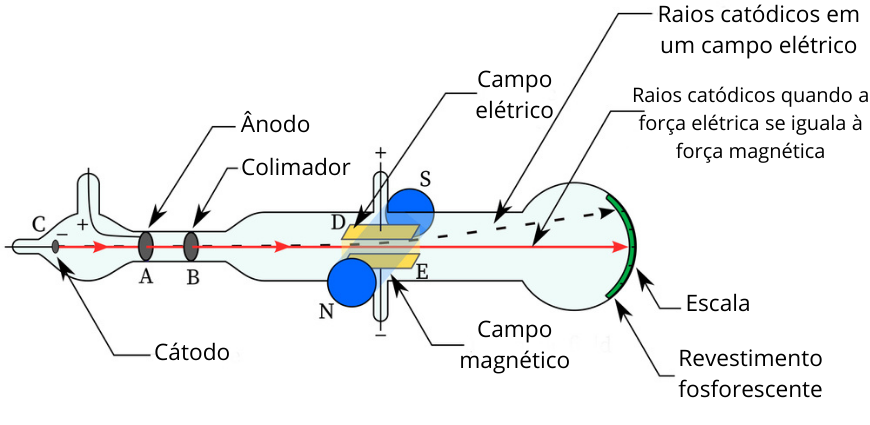
No experimento realizado por J. J. Thomson em uma ampola de Crookes, quando os raios catódicos passavam em um campo elétrico, eram sempre desviados em direção ao lado positivo, mas quando um campo magnético era aplicado perpendicularmente, o desvio já não era mais percebido.
Atualmente, sabemos que o elétron é uma partícula que está presente na estrutura atômica, mais especificamente na eletrosfera, com carga elétrica negativa. Na física quântica, entende-se que o elétron é uma partícula fundamental (ou elementar), ou seja, uma partícula que não possui nenhuma subestrutura. Sendo assim, podemos dizer que Thomson foi o responsável por descobrir a primeira partícula fundamental da história da ciência, feito esse que lhe garantiu o Prêmio Nobel de Física de 1906.
Embora o elétron seja estudado como uma partícula na maioria dos livros do Ensino Médio, sabe-se que, na verdade, o elétron também possui características de uma onda. Em 1924, Louis de Broglie combinou as ideias de Max Planck e Albert Einstein para propor que partículas da matéria, como os elétrons, possuiriam propriedades ondulatórias. Já em 1927, Clinton Davisson e Lester Germer realizaram um experimento em que lançaram elétrons contra um alvo de níquel cristalino. Como resultado, Davisson e Germer observaram um padrão de difração, que é um fenômeno que ocorre quando uma onda encontra um obstáculo. Assim, os dois cientistas comprovaram experimentalmente a hipótese de Louis de Broglie. Em 1931, George Thomson, filho de J. J. Thomson, comprovou definitivamente a hipótese de Louis de Broglie. Por isso, em 1929, de Broglie foi laureado com o Prêmio Nobel de Física, enquanto Davisson e Thomson foram laureados com o mesmo prêmio em 1937.
Leia também: Evolução dos modelos atômicos — a história dos estudos sobre o átomo
Características do elétron
A partir dos estudos de J. J. Thomson e com o aprimoramento da ciência, podemos elencar algumas características do elétron.
-
Massa em quilogramas: 9,11 x 10-31 kg.
-
Massa em unidades de massa atômica: 5,49 x 10-4 u.m.a.
-
Carga elétrica: -1,60 x 10-19 C.
Os elétrons se encontram na região periférica do núcleo atômico, denominada eletrosfera. Entretanto, a mecânica quântica afirma que não é possível determinar simultaneamente a posição e a velocidade do elétron na eletrosfera com extrema precisão. Sendo assim, é impossível descrever uma trajetória para os elétrons na eletrosfera.
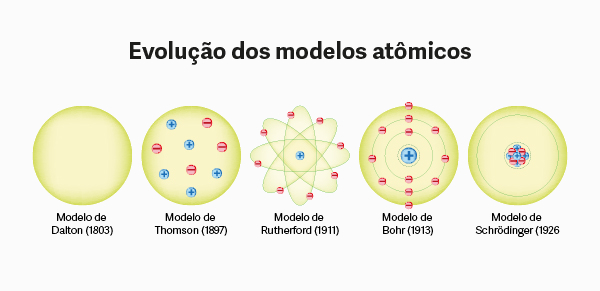
Sua carga elétrica é da mesma intensidade da carga elétrica dos prótons, partículas positivas que estão presentes no núcleo atômico. Entretanto, a massa do próton é cerca de 1836 vezes maior que a massa do elétron.
Elétron e eletricidade
a) A definição de elétron livre
A mecânica quântica estabelece que, se um elétron recebe energia, ele realiza um salto quântico, ou seja, passa para uma camada eletrônica da eletrosfera de maior energia. Caso essa camada eletrônica seja a mais externa (a de valência), esse elétron ultrapassa a barreira potencial do átomo e então sai da estrutura, sendo constituído como um elétron livre.
b) A condução elétrica
Em 1900, o físico alemão Paul Drude criou uma teoria que afirmava que, quando os átomos dos elementos metálicos se unem para formar o metal, seus elétrons da camada de valência, fracamente ligados à estrutura atômica por estarem mais distantes do núcleo positivo, saem da estrutura atômica e passam a se movimentar livremente através do metal, enquanto os íons positivos mantêm-se fixos, formando uma rede cristalina. É o que hoje muitos livros chamam de mar de elétrons.

A teoria de Drude afirma que os elétrons se movimentam aleatoriamente no metal em temperatura ambiente, com velocidade média igual a zero, assim como moléculas de um gás ideal. Ao se estabelecer um campo elétrico dentro do metal, os elétrons adquirem uma pequena velocidade na mesma direção, mas no sentido contrário do campo elétrico. Como a física define que corrente elétrica é, na verdade, cargas em movimento, tem-se então a presença de uma corrente elétrica dentro do metal, possibilitando a condução elétrica.
Embora Hendrik Lorentz tenha refinado a teoria de Drude, o modelo do elétron livre de Drude apresentou falhas em alguns pontos e hoje se tornou obsoleto, muito por conta dessa teoria se utilizar da mecânica estatística clássica, e não da mecânica quântica. Como já vimos anteriormente, o comportamento dos elétrons só pode ser descrito mediante explicações da mecânica quântica.
Mesmo assim, o modelo desenvolvido por Drude foi essencial para se iniciar os estudos com elétrons livres.
Leia também: Distribuição eletrônica — o modo como os elétrons estão distribuídos nos níveis de energia
Qual a função do elétron?
Embora o entendimento do elétron necessite de conhecimentos mais aprofundados acerca da natureza da matéria, como conhecimentos de mecânica quântica, nas aulas de Química do Ensino Médio já é possível perceber como os elétrons são importantes para diversos processos.
Na formação de ligações químicas, sejam elas iônicas, covalentes ou metálicas, os elétrons são os grandes protagonistas desses modelos, sendo os responsáveis pelo estabelecimento de ligações entre átomos de elementos diferentes, possibilitando a formação de compostos iônicos, metálicos e moléculas.

Os elétrons também são importantes para que se explique a condutividade elétrica e térmica dos materiais. Apesar da teoria de Drude estar obsoleta, hoje a mecânica quântica se utiliza da teoria de bandas para corrigir as falhas deixadas por Drude e, assim, trazer uma interpretação mais moderna de como ocorre a condução elétrica e térmica em metais e outras substâncias, possibilitando definições mais precisas de condutores, semicondutores, isolantes e supercondutores.
Exercícios resolvidos
(Enem Digital/2020)
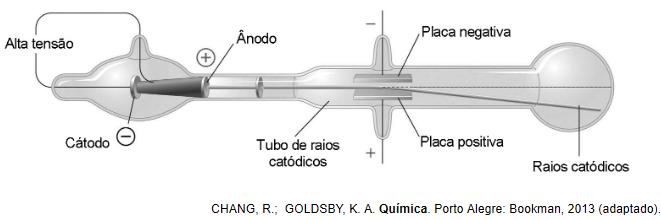
No final do século XIX, muitos cientistas estavam interessados nos intrigantes fenômenos observados nas ampolas de raios catódicos, que são tubos sob vácuo em que se ligam duas placas a uma fonte de alta tensão. Os raios catódicos passam através de um orifício no ânodo e continuam o percurso até a outra extremidade do tubo, onde são detectados pela fluorescência produzida ao chocarem-se com um revestimento especial, como pode ser observado na figura. Medições da razão entre a carga e a massa dos constituintes dos raios catódicos mostram que a sua identidade independe do material do cátodo ou do gás dentro das ampolas.
Essa radiação invisível detectada nas ampolas é constituída por:
(A) ânions.
(B) cátions.
(C) prótons.
(D) elétrons.
(E) partículas alfa.
Resolução
A questão faz alusão ao experimento com raios catódicos em uma ampola de Crookes, ilustrada na questão.
Como se sabe, esses raios foram estudados por muitos cientistas, os quais chegaram à conclusão de possuírem carga elétrica negativa. J. J. Thomson, posteriormente, realizou a medição na razão entre a carga e a massa dos constituintes dos raios catódicos e comprovou que essa razão se repetia independentemente do material do cátodo ou do gás dentro das ampolas. Por isso, Thomson percebeu que esses raios catódicos eram formados por uma partícula universal, ou seja, que existiria em qualquer elemento químico. Essas partículas foram inicialmente chamadas de corpúsculos, mas, posteriormente, foram chamadas de elétrons. Sendo assim, o gabarito é a alternativa D.
(UERJ/2020) Há um tipo de ligação interatômica em que os elétrons das camadas mais externas transitam entre os cátions da rede cristalina. Por essa característica, tal ligação é comparada a um “mar de elétrons”. “Mar de elétrons” é uma metáfora que se refere ao seguinte tipo de ligação:
-
iônica.
-
metálica.
-
covalente.
-
de hidrogênio.
Resolução
O mar de elétrons é uma forma didática de expor a teoria de Drude para elétrons livres, desenvolvida em 1900 pelo físico alemão Paul Drude para explicar a ligação entre os metais, bem como suas propriedades, como a condutividade elétrica e térmica. Segundo essa teoria, quando os átomos dos elementos metálicos se unem para formar o metal, seus elétrons da camada de valência, fracamente ligados à estrutura atômica por estarem mais distantes do núcleo positivo, saem da estrutura atômica e passam a se movimentar livremente através do metal, enquanto os íons positivos mantêm-se fixo, formando uma rede cristalina. Sendo assim, a alternativa correta é a letra B.