Lítio (Li)
O lítio é um elemento químico metálico encontrado em minerais e salmouras, muito usado em baterias recarregáveis de alta energia, eletrônicos e medicamentos psiquiátricos.
Por Jhonilson Pereira Gonçalves

PUBLICIDADE
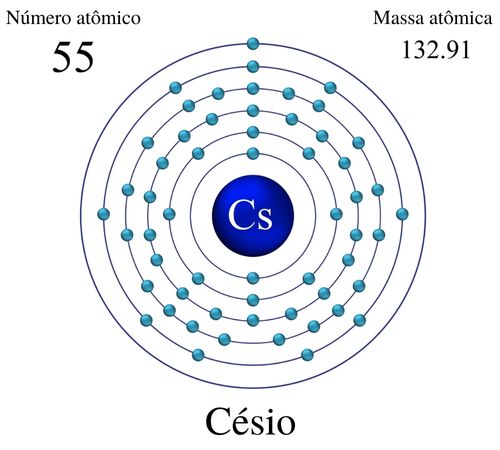
O lítio é um metal alcalino cujo número atômico é 3 e a massa atômica é 6,941 u. A palavra "lítio" tem origem no grego antigo, derivada da palavra "lithos", que significa "pedra"; isso se deve ao fato de que esse metal foi descoberto em minerais de pedra, como o espodumênio e a petalita. Em vista disso, o nome foi proposto pelo químico sueco Johan August Arfwedson, que o descobriu em 1817, abrindo portas para o desenvolvimento de novas tecnologias à medida que se foi conhecendo melhor as características e propriedades desse elemento.
Vale destacar que ele é um componente chave em baterias recarregáveis, usadas em uma vasta gama de dispositivos eletrônicos, como telefones celulares, laptops e veículos elétricos. Portanto, a demanda por lítio tem crescido exponencialmente, impulsionada pela transição global para energias renováveis e pela busca por soluções de armazenamento de energia mais eficientes e sustentáveis.
Leia também: Chumbo — outro metal utilizado na fabricação de baterias e ligas metálicas
Resumo sobre o lítio
-
É um elemento químico do grupo dos metais alcalinos.
-
Foi descoberto em 1817 por Johan August Arfwedson.
-
É um metal macio, prateado e altamente reativo.
-
Pode ser encontrado em minerais e salmouras.
-
É usado em baterias de íon-lítio, ligas metálicas, vidro e cerâmica.
-
Possui aplicações na medicina como estabilizador de humor.
-
Está presente na água do mar em baixas concentrações.
-
Tem potencial uso como fonte de energia limpa.
O que é lítio?
O lítio é um elemento químico que pertence ao grupo dos metais alcalinos, encontrado no grupo 1 da tabela periódica. Nesse sentido, ele é representado pelo símbolo “Li” e possui número atômico 3, o que significa que um átomo desse elemento tem três prótons em seu núcleo. Além disso, ele se destaca por ser um metal macio, prateado e altamente reativo, sendo, dentre os metais, o de menor densidade e, portanto, o mais leve.
Quais são as propriedades do lítio?
-
Símbolo: Li.
-
Número atômico: 3.
-
Massa atômica: 6,94 u.
-
Série química: metal alcalino, pertencente ao grupo 1 da tabela periódica.
-
Configuração eletrônica: [He] 2s¹.
-
Eletronegatividade: 0,98 (escala de Pauling).
-
Afinidade eletrônica: 59,6 kJ/mol.
-
Eletropositividade: 1.
-
Estados de oxidação: +1.
-
Ponto de fusão: 180,5°C.
-
Ponto de ebulição: 1342°C.
-
Densidade: 0,534 g/cm³.
-
Energia de ionização: 520,2 kJ/mol.
-
Estado físico à temperatura ambiente: sólido.
Veja também: Quais são os metais mais reativos?
Para que serve o lítio?
O lítio é usado principalmente em baterias recarregáveis, como, por exemplo, as do tipo íon-lítio, as quais são amplamente utilizadas em dispositivos eletrônicos portáteis, como smartphones, laptops e câmeras digitais, devido à sua alta densidade de energia e à capacidade de recarga. Nesse contexto, veja a seguir um exemplo desse tipo de bateria utilizada em dispositivos móveis:

Além disso, ele é usado em ligas metálicas, na produção de vidro e cerâmica, e também tem aplicações na medicina, sendo utilizado como estabilizador de humor no tratamento de transtornos bipolares. Sendo assim, vale ressaltar que sua presença na água do mar e sua possível utilização como fonte de energia limpa também têm despertado interesse na comunidade científica.
Principais características do lítio
Dentre as características do lítio, podemos destacar três como sendo as mais emblemáticas desse metal. São elas:
-
Baixa densidade: Uma de suas principais características é a densidade, pois o fato de ele ser leve e menos denso que os demais metais faz com que ele seja útil em aplicações como ligas metálicas para aviões e na fabricação de componentes eletrônicos.
-
Condutividade elétrica: Sua alta condutividade elétrica, aliada à sua leveza, o torna um componente crucial em baterias e células de combustível.
-
Reatividade: É altamente reativo, especialmente em contato com a água, com a qual reage formando hidróxido de lítio e liberando hidrogênio. Essa alta reatividade significa que ele não é encontrado livre na natureza, mas sim em compostos.
Obtenção do lítio
A obtenção do lítio envolve principalmente três etapas: extração, concentração e processamento.
-
Extração: O lítio é geralmente extraído de dois tipos de fontes: salmouras e minerais.
-
Extração do lítio de salmouras: Primeiro, entenda que salmouras são águas subterrâneas ricas em lítio, encontradas principalmente em regiões como o Salar de Atacama, no Chile, e o Salar de Uyuni, na Bolívia, conforme é mostrado na imagem abaixo.
-

Logo, a sua extração envolve a bombeamento da salmoura para a superfície e sua concentração por evaporação solar em piscinas.
- Extração do lítio de minerais: Como espodumênio (imagem abaixo), envolve processos de trituração e concentração.

- Concentração: Após a extração, a salmoura ou o minério passa por processos para aumentar a concentração do lítio. Nesse caso, pode envolver métodos como a flotação, em que ele é separado de outros minerais por diferenças em suas propriedades físicas.
-
Processamento: O processamento final envolve a obtenção do lítio metálico ou de compostos de lítio utilizados em diversas aplicações. Essa etapa pode incluir a purificação do metal por eletrólise ou outros métodos para obtê-lo puro, ou ainda a produção de compostos de lítio, como o carbonato de lítio, através de reações químicas específicas.
Onde encontrar lítio?
Devido à sua reatividade, o lítio não é encontrado em estado puro na natureza, mas sim em compostos químicos e geralmente está presente em quantidades diluídas. Nesse contexto, além das salmouras e dos minerais, embora em concentrações muito baixas, ele também está presente na água do mar. Além disso, há a possibilidade de encontrá-lo em produtos reciclados, como baterias de íon-lítio, pois a reciclagem desses produtos pode recuperá-lo para uso em novas aplicações.
Quais são os perigos do lítio?
O lítio pode apresentar alguns perigos, principalmente devido à sua reatividade. Portanto, separamos aqui alguns dos quais requerem atenção:
-
Reatividade com água: Como já foi falado (em tópico anterior), esse elemento é altamente reativo com a água, produzindo hidrogênio gasoso e hidróxido de lítio. Nesse caso, a reação é exotérmica e pode resultar em incêndios ou explosões.
-
Reatividade com o ar: O lítio metálico exposto ao ar pode formar óxidos ou hidróxidos de lítio, os quais são corrosivos e irritantes para a pele e os olhos.
-
Toxicidade: Em sua forma pura ou em compostos pode ser tóxico se ingerido ou inalado em grandes quantidades. Portanto, pode causar sintomas como náusea, vômito, diarreia, tremores, confusão e, em casos graves, problemas renais e cardiovasculares.
História do lítio
Podemos dividir a história do lítio em três grandes momentos: descoberta, isolamento e aplicações. Diante disso, veja a seguir o desdobramento de cada um deles.
O lítio foi descoberto em 1817 pelo químico sueco Johan August Arfwedson, o qual estava analisando amostras de minerais e observou um novo elemento químico em um mineral chamado espodumênio, e o nomeou de “lítio”. Após a descoberta, esse elemento passou a ser estudado por outros químicos e pesquisadores.
O químico alemão Robert Bunsen e o matemático alemão Gustav Kirchhoff isolaram o lítio metálico pela primeira vez em 1855, através da eletrólise de cloreto de lítio fundido. Esse foi um passo importante para entender as propriedades e o comportamento desse metal.
No início do século XX, o lítio começou a ser utilizado em aplicações industriais, principalmente na indústria de vidro e cerâmica, devido às suas propriedades que ajudam a reduzir a temperatura de fusão dos materiais e a melhorar sua durabilidade. Em vista disso, na década de 1940, ele foi descoberto por acidente como um tratamento eficaz para transtornos mentais, como a doença do transtorno de bipolaridade. Desde então, ele tem sido amplamente utilizado como estabilizador de humor em pacientes com esses distúrbios.
Ao longo dos anos, a demanda por lítio aumentou exponencialmente, especialmente com a ascensão da tecnologia de baterias de íon-lítio na década de 1990. Isso levou a um foco intensificado na sua mineração e na exploração de novos depósitos ao redor do mundo, com países como Austrália, Chile e Argentina liderando a produção global.
Saiba mais: Níquel — quais riscos esse metal tão usado no cotidiano representa para a nossa saúde?
Curiosidades sobre o lítio
Separamos aqui algumas curiosidades sobre o lítio que o tornam ainda mais interessantes no ponto de vista de aplicabilidade, como, por exemplo:
-
Capacidade de flutuar na água: Uma curiosidade interessante sobre o lítio é o fato de que ele é o único elemento sólido que pode flutuar na água. Isso ocorre porque ele é o metal menos denso e tem uma densidade menor que a da água. Portanto, se você tivesse um pequeno pedaço de lítio e o colocasse na água, ele flutuaria, ao contrário da maioria dos outros metais, que afundariam.
-
Utilização em foguetes espaciais: O lítio é utilizado em algumas partes dos foguetes espaciais devido à sua baixa massa molar e alta capacidade de armazenamento de energia. Portanto ele é usado em sistemas de aquecimento e em baterias para fornecer energia em condições extremas de temperatura e vácuo do espaço.
-
Efeito no cérebro humano: Alguns estudos sugerem que o lítio pode ter efeitos neuroprotetores e neurogênicos no cérebro humano, o que significa que pode ajudar a proteger e a regenerar células cerebrais. Nesse sentido, esses efeitos têm levado à investigação do seu uso no tratamento de doenças neurodegenerativas, como Alzheimer e Parkinson.
Fontes
BERMÚDEZ -RODRÍGUEZ, Tatiana; CONSONI, Flavia Luciane. Uma abordagem da dinâmica do desenvolvimento científico e tecnológico das baterias lítio-íon para veículos elétricos. Revista Brasileira de Inovação, [s. l.], v. 19, p. e0200014, 2020.
CALVO, Ernesto Julio. Almacenamiento de energía: presente y futuro de baterías de litio. Ciencia e Investigación, [s. l.], p. 5–21, 2018.
GENTIL FILHO, V. Historia do uso dos sais de litio em psiquiatria. Jornal Brasileiro de Psiquiatria, [s. l.], v. 33, n. 3, p. 211–214, 1984.
HOLDEN, Norman E. et al. IUPAC Periodic Table of the Elements and Isotopes (IPTEI) for the Education Community (IUPAC Technical Report). Pure and Applied Chemistry, [s. l.], v. 90, n. 12, p. 1833–2092, 2018.
MEJIA-MUÑOZ, Sara; BABIDGE, Sally. Lithium extractivism: perpetuating historical asymmetries in the ‘Green economy’. Third World Quarterly, [s. l.], v. 44, n. 6, p. 1119–1136, 2023.
PEIXOTO, Eduardo Motta Alves. Lítio. Química Nova na Escola, [s. l.], p. 25, 1995. Disponível em: http://qnesc.sbq.org.br/online/qnesc02/elemento.pdf?agreq=Lítio&agrep=jbcs,qn,qnesc,qnint,rvq.
REDDY, Mogalahalli V. et al. Brief history of early lithium-battery development. Materials, [s. l.], v. 13, n. 8, 2020.
RICO-FONTALVO, Jorge et al. Intoxicación por Litio. Revista de la Sociedad Ecuatoriana de Nefrología, Diálisis y Trasplante, [s. l.], v. 11, n. 1, p. 1–8, 2023.
SCHAWARZ, Stefanie; PÉREZ, Vicente; BETANCOUR, María Cristina. Mercado Internacional del Litio. Comisión Chilena del Cobre, [s. l.], 2018.
SHORTER, Edward. The history of lithium therapy. Bipolar Disorders, [s. l.], v. 11, n. SUPPL. 2, p. 4–9, 2009.
SINGLAU, Federico Alejandro de. Seguridad y recursos naturales estratégicos: el caso del litio. Revista Integración y Cooperación Internacional, [s. l.], n. 35, p. 7–25, 2022.
WIESER, Michael E.; COPLEN, Tyler B. Atomic weights of the elements 2009 (IUPAC technical report). Pure and Applied Chemistry, [s. l.], v. 83, n. 2, p. 359–396, 2011.