Dissociação dos sais
A dissociação dos sais é um fenômeno de liberação de íons que ocorre quando esses compostos são adicionados à água ou quando passam pelo processo de fusão.
Por Diogo Lopes Dias

PUBLICIDADE
A dissociação dos sais é um fenômeno físico que ocorre com esses compostos quando são dissolvidos em água ou quando são fundidos, isto é, quando passam do estado sólido para o estado líquido por meio de aquecimento.
Assim como nas bases, a dissociação dos sais é um fenômeno físico pelo fato de essas substâncias serem formadas por ligações iônicas, ou seja, pela interação entre íons (um cátion e um ânion).
Dessa forma, como já apresentam os íons em sua composição, quando um sal se dissolve em água ou sofre fusão, esses íons são apenas liberados. Observe a equação química que representa a dissociação dos sais:
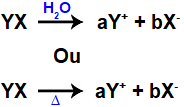
Equação geral da dissociação de um sal
Nessa equação geral, é importante notar que, quando um sal se dissocia, é liberada uma quantidade em mol de cátion (a) e outra de ânion (b).
Outro fator muito importante na dissociação dos sais é saber reconhecer ou indicar a carga que o cátion e o ânion apresentam, já que esse dado também deve estar presente em uma equação de ionização.
Para determinar o número de mol dissociado e a carga de cada íon do sal, basta obedecer uma das seguintes opções de regras, de acordo com o tipo de sal:
-
1º Caso: Sal que não apresenta índices na fórmula
![]()
Sais que não apresentam índice na fórmula
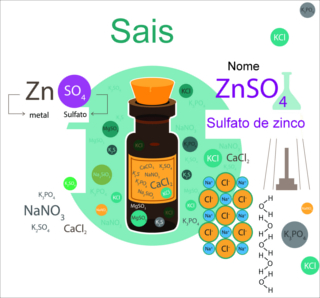
Consideramos que um sal não apresenta índices em sua fórmula quando não houver na sigla nenhum número (como no NaCl), no caso do 4 do NH4Cl, ou no caso de qualquer número para o oxigênio (CuSO4). Nesses casos, o número de mol será igual a 1.
A ausência de índice demonstra que as cargas dos íons apresentam mesmo valor, mas com sinais contrários, sendo que o ânion sempre determina esse valor, já que alguns cátions podem variar seu NOX.
1º Exemplo: Dissociação do fosfato de cromo III
![]()
Equação geral da dissociação do fosfato de cromo III
Tanto no Cr quanto no PO4 não existe índice, por isso, a quantidade em mol de ambos será igual a 1 mol. Como não possuem índice, a carga tem mesmo valor e é determinada pelo ânion fosfato (PO4-3), cuja carga é -3. Assim, a carga do cátion cromo será III (Cr+3).
-
2º Caso: Sal que apresenta um índice na fórmula
![]()
Exemplos de sais que apresentam apenas um índice
Um sal apresenta apenas um índice em sua fórmula quando existir um número na sigla do primeiro elemento, quando na frente do último elemento não houver nenhum número, ou quando houver apenas um número para o oxigênio, que estará do lado de fora dos parênteses. Nesses casos, o número de mol será diferente.
A presença de índice revela que os íons não apresentam cargas de mesmo valor, além de a carga do ânion ser o valor do índice do cátion e vice-versa. No carbonato de prata (Ag2CO3), por exemplo, a carga do Ag é +1 (por haver índice 1 na frente do carbonato), e a do carbonato é -2 (por ter o índice 2 na frente da prata).
2º Exemplo: Dissociação do sulfeto de cobre I
![]()
Equação geral da dissociação do sulfeto de cobre I
Nesse sal, o Cu tem índice 2, e não há índice no S, por isso a quantidade em mol de Cu dissociado será de 2 mol, e do S será de 1 mol. Como nesses casos o valor da carga é inverso ao íon existente na fórmula, a carga do íon cobre é +1 (Cu+1) e do ânion sulfeto é -2 (S-2).
-
3º Caso: Quando o sal apresenta dois índices na fórmula
![]()
Sais que apresentam dois índices na fórmula
Um sal apresenta dois índices em sua fórmula quando existe um número na sigla do primeiro elemento, na frente do último elemento ou quando esse número no oxigênio está do lado de fora dos parênteses. Nesses casos, o número de mol será diferente.
A presença dos índices demonstra que os íons não têm cargas de mesmo valor, sendo que a carga do ânion é o valor do índice do cátion e vice-versa. No dicromato de ouro III (Ag2CO3), por exemplo, a carga do Au é +3 (pois há o índice 3 na frente do dicromato), e a do dicromato é -2 (por haver o índice 2 na frente do ouro).
3º Exemplo: Dissociação do sulfato de alumínio
![]()
Equação geral da dissociação do sulfato de alumínio
Nesse sal, há o índice 2 no Al e o índice 3 no SO4, por isso a quantidade em mol de Al dissociado será 2 mol e do SO4 será 3 mol. Como é um caso com dois índices, ao intervertê-los, temos as cargas dos íons, ou seja, o íon alumínio será +3 (Cu+3) e do ânion sulfato será -2 (SO4-2).