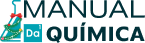Hidrólise salina ácida
A hidrólise salina ácida resulta em um equilíbrio químico em que o cátion hidrônio permanece livre na solução por não interagir ou sofrer hidrólise com o ânion do sal.
Por Diogo Lopes Dias
PUBLICIDADE
A hidrólise salina ácida ocorre quando o cátion (Y+) do sal interage com o ânion hidróxido (OH-) proveniente da água, formando uma base fraca (YOH), e o ânion do sal (X-) não interage com o cátion hidrônio (H+) proveniente da água.
Equações que representam o equilíbrio de hidrólise salina ácida de um sal qualquer.
Conceitos importantes
Para um melhor entendimento sobre a hidrólise salina ácida, é fundamental entender cada um dos conceitos a seguir:
- Dissociação dos sais
É um fenômeno físico que ocorre sempre que um sal é colocado na água, havendo liberação de íons formadores do sal. Para entender melhor, clique aqui.
- Autoionização da água
É um fenômeno químico em que a água produz, de forma espontânea, o cátion hidrônio (H+) e o ânion hidróxido (OH-), como podemos observar na equação a seguir:
- Força dos ácidos
Os ácidos, de forma geral, podem ser classificados em fortes, moderados ou fracos. Essa classificação está intimamente relacionada com a presença (oxiácidos) ou não (hidrácidos) de oxigênio na composição do ácido.
-
Fortes: os hidrácidos são o HCl, HBr e HI, e os oxiácidos são todos aqueles em que a subtração entre a quantidade de oxigênios e hidrogênios é, no mínimo, igual a 2.
-
Moderados: o hidrácido é HF, e os oxiácidos são todos aqueles em que a subtração entre a quantidade de oxigênios e hidrogênios é igual a 1.
-
Fracos: qualquer outro hidrácido diferente dos citados anteriormente, e os oxiácidos são todos aqueles em que a subtração entre a quantidade de oxigênios e hidrogênios é igual a 0.
- Força das bases
As bases podem ser classificadas em fortes ou fracas.
-
Base forte: apresenta elemento da família IA ou IIA (com exceção do magnésio).
-
Base fraca: apresenta qualquer elemento diferente dos citados acima.
Exemplos de hidrólise ácida
-
Sulfato de alumínio Al2(SO4)3
Quando esse sal é colocado na água, sofre dissociação:
![]()
Equações que representam o equilíbrio de dissociação do Al2(SO4)3.
Ao sofre dissociação, o sulfato de alumínio libera o cátion alumínio (Al+3) e o ânion sulfato (SO-24). Além desses íons, existem ainda o cátion hidrônio e o ânion hidróxido, ambos provenientes da água.
Dizemos que o sulfato de alumínio sofre hidrólise ácida porque sobra no meio o cátion hidrônio (H+). Isso ocorre porque o cátion alumínio (que pertence à família III A), ao se unir com o ânion hidróxido, origina uma base fraca. O ânion sulfato (SO4-2), por sua vez, não sofre hidrólise com o hidrônio (H+), pois o resultado seria um oxiácido forte, o ácido sulfúrico (H2SO4).
3.jpg)
Equações que representam o equilíbrio de hidrólise salina ácida do Al2(SO4)3.
Logo, na solução, temos a presença dos íons hidrônio e, por isso, trata-se de um meio ácido (pH tende a ser menor que 7).
-
Brometo de magnésio (MgBr2)
Quando esse sal é colocado na água, sofre dissociação:
![]()
Equação que representa o equilíbrio de dissociação do MgBr2.
Ao sofre dissociação, o brometo de magnésio libera o cátion magnésio (Mg+2) e o ânion brometo (Br-1). Além desses íons, existem ainda o cátion hidrônio e o ânion hidróxido, ambos provenientes da água.
Dizemos que o sal brometo de magnésio sofre hidrólise ácida porque sobrar no meio o cátion hidrônio (H+). Isso ocorre porque o cátion magnésio (que pertence à família II A), ao se unir com o ânion hidróxido, origina uma base fraca. O ânion brometo (Br-1), por sua vez, não sofre hidrólise com o hidrônio (H+), pois o resultado seria um hidrácido forte, o ácido bromídrico (HBr).
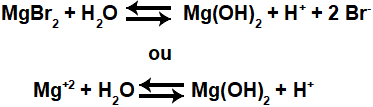
Equações que representam o equilíbrio de hidrólise salina ácida do MgBr2.
Logo, na solução, temos a presença dos íons hidrônio (H+) e, por isso, trata-se de um meio ácido (pH tende a ser menor que 7).