Reações de simples troca ou deslocamento
As reações de simples troca ou deslocamento ocorrem quando uma substância simples reage com uma composta, formando uma nova substância simples e outra composta.
Por Jennifer Rocha Vargas Fogaça

PUBLICIDADE
As reações de simples troca ou deslocamento são aquelas que ocorrem entre uma substância composta (formada por mais de um elemento químico) e uma substância simples (formada por somente um tipo de elemento químico), originando outra substância simples e outra composta.
Genericamente, temos:
A + XY → AX + Y ou A + XY → AY + X
Em Química Inorgânica, essas reações são denominadas dessa forma, mas quando elas são estudadas em Físico-Química, recebem o nome de reações de oxirredução. Isso porque a substância simples retira da substância composta uma nova substância simples, pois ocorre transferência de elétrons entre as espécies químicas. Quando um elemento ganha elétrons, dizemos que ele sofreu uma redução. Por outro lado, quando há perda de elétrons, trata-se de uma oxidação.
Vejamos um exemplo: um pedaço de zinco metálico (nossa substância simples) é mergulhado em uma solução de ácido clorídrico (nossa substância composta). Observe a reação de simples troca que ocorre:
Zn(s) + 2 HCl(aq) → ZnCl2(aq) + H2(g)
A partir da reação, percebemos que o zinco deslocou o hidrogênio do HCl e foi formada uma nova substância composta, o cloreto de zinco, e outra substância simples, o gás hidrogênio. A figura no início deste artigo mostra essa reação. Observe a formação de bolhas que indica a formação do gás hidrogênio.
Mas por que essa reação ocorreu? Porque houve transferência de elétrons entre as espécies químicas.
Observe agora a mesma reação, porém com os números de oxidação de cada elemento:
.jpg)
Transferência de elétrons (oxidação e redução) em reação entre zinco e ácido clorídrico
Veja que o zinco metálico (Zn) perdeu dois elétrons (sofreu oxidação), tornando-se o cátion zinco (Zn2+) que está presente na solução de cloreto de zinco. Esses elétrons foram recebidos (redução) pelo cátion hidrogênio (H+) que estava presente na solução de ácido clorídrico e que formou o gás hidrogênio (H2).
Isso nos mostra claramente que, para que as reações de deslocamento ou oxirredução ocorram, é necessário que a substância simples seja mais reativa que o elemento que será deslocado da substância composta. No exemplo acima, o zinco metálico era mais reativo que o hidrogênio e, por isso, a reação aconteceu.
No entanto, se mergulhássemos uma placa de cobre (Cu) em uma solução de sulfato de zinco (ZnSO4), por exemplo, a reação de simples troca não ocorreria.
Cu(s) + ZnSO4(aq) → não ocorre
Isso porque o zinco é mais reativo que o cobre, logo este não conseguiria deslocar o zinco do sulfato.
Por outro lado, se colocarmos uma placa de zinco em uma solução de sulfato de cobre II, a reação ocorrerá, com formação de cobre metálico e uma solução de sulfato de zinco:
Zn(s) + CuSO4(aq) → Cu(s) + ZnSO4(aq)
A ocorrência dessa reação é facilmente visualizada porque a solução inicialmente continha íons cobre (Cu2+) que conferiam a cor azul. Mas quando a reação ocorre, a solução vai ficando incolor com o passar do tempo, pois os cátions cobre ganham elétrons e formam o cobre metálico, que é depositado em cima da placa de zinco.
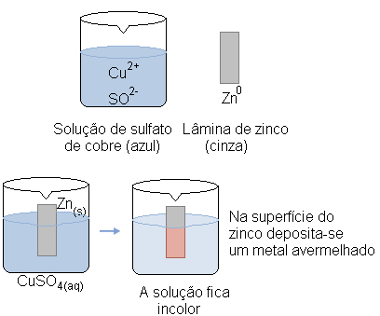
Reação de oxirredução entre zinco e sulfato de cobre II
Assim, sempre que você quiser saber se uma reação de simples troca ou deslocamento ocorrerá, consulte a fila de reatividade dos metais ou a fila de reatividade dos ametais, ambas mostradas a seguir. Se o elemento da substância simples estiver à esquerda do elemento da substância composta, então a reação ocorrerá de fato. Veja na fila de reatividade dos metais que o zinco (Zn) está situado à esquerda do hidrogênio (H) e do cobre (Cu):

Fila de reatividade dos metais e dos ametais
Por Jennifer Fogaça
Graduada em Química
Aproveite para conferir nossa videoaula sobre o assunto:











