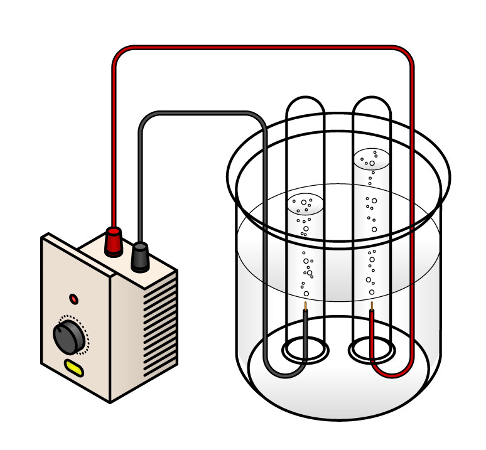
Cálculos relacionados à eletrólise
Os cálculos relacionados à eletrólise são utilizados para determinar diversos parâmetros que podem ser obtidos nesse processo eletroquímico, como a massa de metal produzida.
Por Diogo Lopes Dias
PUBLICIDADE
Os cálculos relacionados à eletrólise são recursos matemáticos utilizados para quantificar diversos aspectos fundamentais referentes ao fenômeno da eletrólise, como:
• Massa do metal a ser depositada;
• Tempo de ocorrência do processo;
• Quantidade de matéria (número de mol) de elétrons;
• Massa produzida durante uma eletrólise em série;
• Cálculo do pH da solução após a eletrólise;
• Determinação do volume de gás produzido durante a eletrólise.
Para realizar os cálculos referentes à eletrólise, é importante conhecer as fórmulas que podem ser utilizadas:
1ª Fórmula: para cálculo da carga elétrica utilizada:
Q = i.t
• Q é quantidade de carga;
• i é a corrente;
• t é o tempo.
2ª Fórmula: para cálculo da massa depositada:
m = i.t.E
96500
3ª Fórmula: para cálculo da massa durante eletrólise em série:
mA = mB
EA EB
Cálculo relacionado à eletrólise envolvendo a determinação da carga do metal
Exemplo: (Unicap-PE) Determinar a valência de um metal com base nas seguintes informações: a eletrólise, durante 150 minutos, com uma corrente de 0,15 A de uma solução salina do metal, cuja massa atômica é 112 u, depositou 0,783 g desse metal.
Dado: faraday = 96.500 C
• Tempo (t): 150 minutos ou 9000 segundos (após multiplicar por 60)
• Massa formada na eletrólise: 0,783 g
• Corrente (i): 0,15 A
• Massa atômica do elemento: 112 u
• Valência (NOX) do metal (k): ?
Para calcular a carga do metal durante a eletrólise, utilizamos a seguinte sequência de raciocínio:
1ª parte: Calcular o equivalente-grama do metal (E) utilizando os dados na seguinte fórmula:
m = i.t.E
96500
0,783 = 0,15.9000.E
96500
0,783.96500 = 0,15.150.E
75559,5 = 1350E
E = 75559,5
1350
E = 55,97
2ª parte: Calcular a valência utilizando os dados na fórmula do equivalente-grama:
E = M
k
55,97 = 112
k
55,97.k = 112
k = 112
55,97
k = 2
Cálculo envolvendo a determinação da massa produzida na eletrólise
Exemplo: (UFSC) A massa atômica de um elemento é 119 u. O número de oxidação desse elemento é + 4. Qual é a massa depositada desse elemento quando se fornece na eletrólise 9.650 Coulomb?
Dado: 1 faraday = 96.500 C.
a) 11,9 g
b) 9650 × 119 g
c) 1,19 g
d) 2,975 g
• Tempo (t): 150 minutos ou 9000 segundos (após multiplicar por 60)
• Q: 9650 C
• m = ?
• Massa atômica do elemento: 119 u
• Valência do metal (k): +4
Para calcular a carga do metal na eletrólise, utilizamos a seguinte sequência de raciocínio:
1ª parte: Calcular o equivalente-grama do metal a partir da seguinte fórmula:
E = M
k
E = 119
4
E = 29,75
2ª parte: Calcular a massa depositada nessa eletrólise por meio da seguinte fórmula:
m = Q.E
96500
m = 9650.29,75
96500
m = 287087,5
96500
m = 2975 g
Cálculo envolvendo a determinação da massa produzida de metais em uma eletrólise em série
Exemplo: (Unimep-SP) Têm-se duas cubas eletrolíticas ligadas em série, contendo, respectivamente, CrCl3 e AgNO3. Fornecendo-se uma corrente de 12 A durante seis minutos, serão depositadas aproximadamente: (Dados de massas atômicas: Cr = 52; Ag = 108; e F = 96.500)
a) 4,8348 g de Cr e 0,7760 g de Ag;
b) 0,7760 g de Cr e 4,8348 g de Ag;
c) 1,4580 g de Cr e 2,4254 g de Ag;
d) 0,1080 g de Cr e 0,2160 g de Ag;
e) 0,4834 g de Cr e 7,7600 g de Ag.
• Tempo (t): 6 minutos ou 360 segundos (após multiplicar por 60)
• Massa atômica do Cr: 52 u
• Corrente (i): 12 A
• Massa atômica do Ag: 108 u
1ª parte: Calcular o equivalente-grama do metal crômio por meio da seguinte fórmula:
E = M
k
E = 52
3
E = 17,33
2ª parte: Calcular a massa de crômio depositada nessa eletrólise mediante a seguinte fórmula:
m = i.t.E
96500
m = 12.360.17,33
96500
m = 74865,6
96500
m = 0,77 g (aproximadamente)
3ª parte: Calcular o equivalente-grama do metal prata por meio da seguinte fórmula:
E = M
k
E = 108
1
E = 108
4ª parte: Calcular a massa de prata depositada utilizando o seu equivalente-grama e o equivalente-grama do crômio e a massa do crômio na fórmula a seguir:
mAg = mCr
EAg ECr
mAg = 0,77
108 17,33
mAg.17,33 = 108.0,77
mAg.17,33 = 83,16
mAg = 83,16
17,33
mAg = 4,79 g (aproximadamente)
Cálculo relacionado à eletrólise envolvendo determinação do número de mol de elétrons
Exemplo: (FCChagas-BA) Quantos mols de elétrons devem passar por um circuito elétrico a fim de que o cátodo, constituído por uma peça metálica mergulhada em solução de CrCl3, receba uma cobertura de 5,2 gramas de Cr? Dado: massa atômica do crômio = 52 u.
a) 0,15 mol de elétrons
b) 0,20 mol de elétrons
c) 0,25 mol de elétrons
d) 0,30 mol de elétrons
e) 0,35 mol de elétrons
• Massa depositada: 5,2 g
• Massa atômica do crômio = 52 u
• Fórmula da substância: CrCl3
Para determinar o numero de mol de elétrons que passam pelo circuito da eletrólise, devemos realizar a seguinte sequência:
1ª Parte: Determinar o número de mol de elétrons necessários para reduzir o cátion metálico do crômio:
O crômio nesse sal apresenta carga +3, o que pode ser consultado na própria fórmula. Logo, são necessários 3 mol de elétrons para reduzir o crômio.
2ª Parte: Determinar o número de mol necessário para gerar 5,2 g de crômio metálico.
Para isso, basta realizar a seguinte regra de três:
52 g de crômio (massa molar)-------3 mol de elétrons
5,2 g de crômio depositado------x
52.x = 5,2.3
x = 15,6
52
x = 0,3 mol de elétrons
Cálculo envolvendo a determinação do pH da solução em eletrólise
Exemplo: (Unicap-PE) 100 mL de uma solução de NaCl, com 0,03 M, é eletrolisada durante 1 min e 40 segundos por uma corrente de 0,965 A. Qual é o pH da solução após a eletrólise? Obs.: Considere que não houve variação de volume líquido. M.A.: Na = 23 u e Cl = 35,5 u
• Volume da solução 100 mL
• Concentração molar da solução: 0,03 M
• Tempo (t): 1 minuto e 40 segundos (total de 100 segundos)
• Corrente (i): 0,965 C
• Massa atômica do elemento: 119 u
• Valência do metal (k): +1
Para calcular o pH, utilizamos a seguinte sequência de raciocínio:
1ª parte: Calcular o equivalente-grama do metal (sódio) por meio da seguinte fórmula:
E = M
k
E = 23
1
E = 23
2ª parte: Calcular a massa de sódio depositada nessa eletrólise por meio da seguinte fórmula:
m = i.t.E
96500
m = 0,965.100.23
96500
m = 2219,5
96500
m = 0,023 g
3ª parte: Calcular a quantidade em mol de sódio:
23 g--------1 mol
0,023 g-------x
23.x = 0,023.1
x = 0,023
23
x = 0,001 mol
4ª parte: Cálculo da concentração da base formada:
Como a eletrólise em meio aquoso do NaCl forma cloro gasoso e hidróxido de sódio, o sódio calculado anteriormente está relacionado com a base (hidróxido de sódio formado). Logo, ocorre a formação de 0,001 mol de base. Assim, a concentração é de 10-2 mol/L de base.
5ª parte: Cálculo da concentração da base formada:
Como há uma base na solução, calculamos inicialmente o pOH. Como a base tem apenas 1 OH na fórmula, a concentração de íons OH- é a mesma da base, a qual é utilizada na expressão a seguir:
pOH = -log[OH-]
pOH = -log 10-2
pOH = 2
6ª parte: Cálculo do pH.
Para isso, basta utilizar o valor do pOH encontrado na fórmula abaixo:
pH + pOH = 14
pH + 2 = 14
pH = 14 – 2
pH = 12
Cálculo envolvendo a determinação do tempo de ocorrência da eletrólise
Exemplo: (UFRGS-RS) Para que uma corrente de 1 A deposite 63,54 g de Cu em uma célula eletrolítica, a partir de uma solução de CuSO4, deve ser aplicada durante: (Cu = 63,54 u; F = 96.500 C)
a) 1 s
b) 63,5 s
c) 48.250 s
d) 96.500 s
e) 193.000 s
• Tempo (t): 150 minutos ou 9000 segundos (após multiplicar por 60)
• Massa formada na eletrólise: 63,54 g
• Corrente (i): 1 A
• Massa atômica do elemento: 63,5 u
• Valência do metal (k): +2
Para calcular a carga do metal na eletrólise, utilizamos a seguinte sequência de raciocínio:
1ª parte: Calcular o equivalente-grama do metal prata por meio da seguinte fórmula:
E = M
k
E = 63,5
2
E = 31,75
2ª parte: Calcular o tempo decorrido na eletrólise utilizando os dados na seguinte fórmula:
m = i.t.E
96500
63,54 = 1.t.31,75
96500
63,54.96500 = 1.31,75.t
613161 = 31,75t
t = 613161
31,75
t = 193121 s (aproximadamente)
Cálculo envolvendo a determinação do volume de um gás formado na eletrólise
Exemplo: (FEI-SP) Uma corrente elétrica atuando numa solução de NaCl liberta, depois de um certo tempo, três litros de cloro nas condições normais. A mesma corrente elétrica atuando numa solução de cloreto de ferro-III, durante o mesmo tempo e nas mesmas condições, liberta um volume de cloro igual a:
a) 1 L.
b) 9 L.
c) 3 L.
d) 2 L.
e) 5 L.
• Sal 1: NaCl
• Sal 2: FeCl3
• Corrente utilizada em ambos os sais: x
• Volume de cloro produzido a partir do sal 1: 3 L
• Tempo de eletrólise de ambos os sais: y
A resolução segue a sequência abaixo:
1ª Parte: Dissociação dos sais.
NaCl → Na+ + Cl-
FeCl3→ Fe+3 + 3Cl-
2ª Parte: Oxidação do ânion cloro.
• Para o NaCl:
Existe apenas 1 mol de Cl-, o qual, quando oxida, forma 1 mol de Cl2 e libera 1 mol de elétron. Porém, a equação exige balanceamento, como a seguir:
2Cl-→ Cl2(g) + 2e
• Para o FeCl3
Existem apenas 3 mol de Cl-, que, ao oxidar, formam 1 mol de Cl2 e libera 3 mol de elétron. Porém, a equação exige balanceamento. Assim:
6Cl-→ 3 Cl2(g) + 6 2e
3ª Parte: Interpretação.
Cada sal, NaCl e FeCl3, origina uma quantidade em mol diferente de cloro gasoso (Cl2), como foi possível observar anteriormente. No entanto, ambos estão sendo submetidos a uma mesma corrente, por uma mesma duração. Logo, suas eletrólises originam o mesmo volume, ou seja, 3 L.
Por Me. Diogo Lopes Dias
Aproveite para conferir nossa videoaula relacionada ao assunto: