pH
O pH é a medida que indica a acidez ou a basicidade de uma solução, essencial para processos biológicos, químicos e industriais, garantindo equilíbrio e segurança.
Por Everton da Paz Silva

PUBLICIDADE
O pH é uma medida que indica a acidez ou basicidade de uma solução, conforme a concentração de íons hidrogênio (H⁺). A sigla "pH" vem do alemão Potenz Hydrogen, que significa "potência de hidrogênio". A escala de pH vai de 0 a 14, onde valores menores que 7 indicam soluções ácidas, maiores que 7 indicam soluções básicas, e o valor 7 representa uma solução neutra, como a água pura. O conceito de pH é fundamental em diversas áreas da ciência, como Química, Biologia e Medicina, pois o equilíbrio ácido-base de uma solução pode influenciar reações químicas, processos biológicos e até o funcionamento de organismos vivos.
Leia também: Chuva ácida — fenômeno atmosférico de precipitação que possui elevada acidez
Resumo sobre o pH
- O pH é uma medida que indica o nível de acidez ou basicidade de uma solução.
- Soluções básicas apresentarem um pH maior que 7, devido à menor concentração de íons H⁺ e à presença de íons hidróxido (OH⁻).
- Soluções ácidas apresentarem um pH menor que 7, devido à alta concentração de íons H⁺.
- A escala varia de 0 a 14, onde cada valor indica uma mudança de dez vezes na concentração de íons H⁺.
- O pH é utilizado para garantir a qualidade de diferentes processos, que vão desde a indústria até o funcionamento de organismos vivos.
- O cálculo do pH é feito com base na concentração de íons H⁺, através da fórmula pH = − log [H+].
- O pH pode ser medido por diferentes métodos, como indicadores, fitas de pH e o peagâmetro.
- O peagâmetro é um instrumento utilizado para medir com precisão o pH de uma solução.
- O pH é importante em diversas áreas da vida cotidiana, fundamental em processos químicos, biológicos e meio ambiente.
O que é pH?
O pH é uma medida que indica o nível de acidez ou basicidade de uma solução, de acordo com a concentração de íons hidrogênio (H⁺) presentes. Ele varia em uma escala de 0 a 14, onde valores abaixo de 7 representam soluções ácidas, como o suco de limão, e valores acima de 7 indicam soluções básicas, como a água sanitária. O valor 7 é considerado neutro, como na água pura. Diferentes substâncias presentes no nosso cotidiano apresentam pH básico ou ácido, como mostra a imagem abaixo.
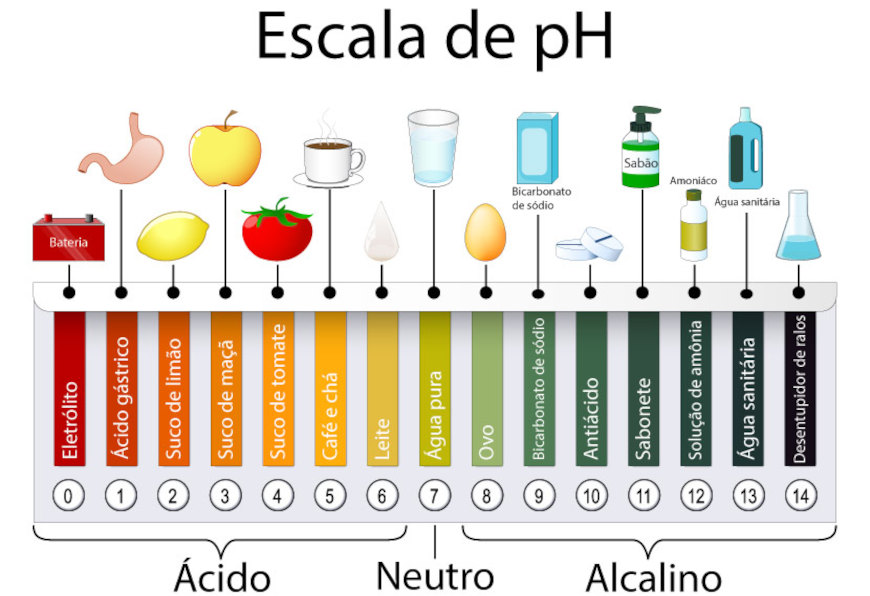
→ Exemplos de soluções básicas
Soluções básicas são caracterizadas por apresentarem um pH maior que 7, devido à menor concentração de íons H⁺ e à presença de íons hidróxido (OH⁻).
No cotidiano, exemplos comuns de soluções básicas incluem o sabão, utilizado na limpeza, e a água sanitária, empregada como desinfetante. Outros exemplos incluem o bicarbonato de sódio, usado em receitas e como antiácido, e a amônia (NH3), presente em produtos de limpeza doméstica. Na indústria, soluções de hidróxido de sódio (NaOH) ou hidróxido de cálcio (Ca(OH)₂) são amplamente utilizadas para controle de pH em processos químicos.
→ Exemplos de soluções ácidas
Soluções ácidas são caracterizadas por apresentarem um pH menor que 7, devido à alta concentração de íons H⁺. No nosso dia a dia, o vinagre (ácido acético) e o suco de limão (ácido cítrico) são exemplos clássicos de soluções ácidas.
Outros exemplos incluem bebidas gasosas, que contêm ácido carbônico, e o ácido clorídrico presente no estômago, essencial para a digestão.
Em ambientes industriais, ácidos como o ácido sulfúrico (H₂SO₄) são amplamente utilizados em baterias e na produção de fertilizantes, enquanto o ácido nítrico (HNO₃) tem aplicações na fabricação de explosivos e corantes.
Escala de pH
A escala de pH é uma escala logarítmica, criada pelo químico dinamarquês SØren SØrensen em 1909, para quantificar a acidez ou basicidade de uma solução.
A escala de pH varia de 0 a 14, onde cada valor indica uma mudança de dez vezes na concentração de íons H+. Por exemplo, uma solução com pH 4 tem dez vezes mais íons H+ do que uma solução com pH 5, como mostra a imagem abaixo.
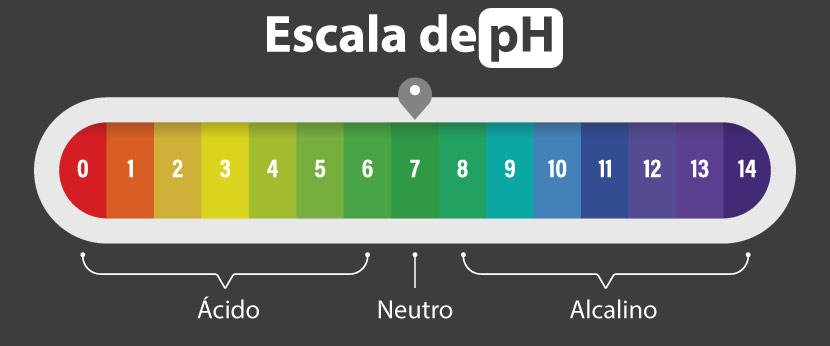
Na prática, essa escala é utilizada para classificar diversas substâncias, desde ácidos fortes, como o ácido clorídrico (pH próximo de 0), até bases fortes, como o hidróxido de sódio (pH próximo de 14). A água pura, com pH 7, é o ponto de referência, sendo neutra por possuir concentrações iguais de H+ e OH⁻.
Para que serve o pH?
O pH serve para medir a acidez ou basicidade de soluções em diversas situações práticas. Na agricultura, por exemplo, o pH do solo deve ser monitorado, pois ele influencia diretamente a disponibilidade de nutrientes para as plantas, como mostra a imagem abaixo.

Em corpos de água, como rios e lagos, o controle do pH é essencial para manter o equilíbrio ecológico, garantindo a sobrevivência de peixes e outros organismos.
Na Biologia, o pH é crítico para o funcionamento de enzimas, já que a atividade enzimática depende de um pH específico. Além disso, o pH é utilizado em tratamentos de água potável e em processos industriais, como na fabricação de cosméticos e alimentos.
Como calcular o pH?
O cálculo do pH é feito de acordo com a concentração de íons H+ na solução. A fórmula para determinar o pH é:
pH = − log [H+]
- Exemplo 1: cálculo de pH de um ácido forte
Considere uma solução de ácido clorídrico (HCl) com concentração de 0,01 mol/L. Sabemos que HCl é um ácido forte, que se dissocia completamente em H+ e Cl⁻. Portanto, a concentração de íons H+ também será 0,01 mol/L.
pH = − log (0,01) = 2
Ou seja, a solução tem um pH igual a 2, sendo uma solução ácida.
- Exemplo 2: cálculo de pH de uma base forte
Agora, considere uma solução de hidróxido de sódio (NaOH) com concentração de 0,001 mol/L. O NaOH é uma base forte que se dissocia completamente em Na+ e OH⁻. A concentração de íons OH⁻ será 0,001 mol/L. Para calcular o pH, primeiro precisamos determinar o pOH, através da seguinte fórmula:
pOH = − log [OH−]
Substituindo o valor da concentração de íons OH−, temos
pOH = − log(0,001) = 3
Sabendo que:
pH + pOH = 14
Temos:
pH = 14 − 3 = 11
Assim, o pH da solução de NaOH é 11, caracterizando-a como uma solução básica.
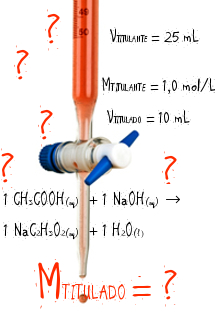
- Exemplo 3: cálculo de pH de um ácido fraco
Para um ácido fraco como o ácido acético (CH₃COOH), com concentração de 0,1 mol/L e constante de dissociação ácida (Ka) de 1,8 × 10⁻5, o cálculo do pH envolve a fórmula:
pH = − log \(\sqrt{Ka \times [\text{ácido}]} \)
Substituindo os valores de Ka e da concentração ácida [ácido], temos
pH = − log \(\sqrt{1,8 \times 10^{-5} \times 0,1} \cong\) 2,87
Logo, a solução de ácido acético tem um pH de aproximadamente 2,87.
Veja também: Qual é o pH do solo?
Como medir o pH?
O pH é medido por meio de diversos métodos, sendo os mais comuns o uso de indicadores, fitas de pH e o peagâmetro.
A fenolftaleína é um indicador de pH amplamente utilizado em soluções ácidas e básicas. Em meio ácido, permanece incolor, enquanto em soluções básicas assume uma coloração rosa. Essa mudança ocorre entre os valores de pH 8,2 e 10, tornando a fenolftaleína ideal para identificar bases. Sua utilização é comum em laboratórios, principalmente em titulações, onde ajuda a determinar o ponto de neutralização de ácidos e bases, como mostra a imagem abaixo.

As fitas de pH, impregnadas com substâncias que mudam de cor conforme o pH, são uma maneira rápida e prática de medir o pH aproximado de uma solução.

Peagâmetro
O peagâmetro é um instrumento utilizado para medir com precisão o pH de uma solução. Ele funciona por meio de um eletrodo sensível à concentração de íons hidrogênio (H+), chamado de eletrodo de vidro, como mostra a imagem abaixo.

Esse eletrodo é imerso na solução a ser medida, e a concentração de íons H+ interage com a membrana de vidro do eletrodo, gerando uma diferença de potencial elétrico. A principal estrutura do peagâmetro inclui dois componentes essenciais:
- Eletrodo de vidro: é o sensor primário que detecta as variações de íons H+. Quando o eletrodo entra em contato com a solução, há uma troca de íons entre a solução e a superfície do eletrodo. Quanto maior a concentração de íons H+, maior será a diferença de potencial gerada entre o eletrodo de vidro e o eletrodo de referência.
- Eletrodo de referência: complementa o eletrodo de vidro. Ele contém uma solução interna de concentração conhecida e gera um potencial constante. Isso permite que o peagâmetro compare a diferença de potencial entre o eletrodo de vidro e o eletrodo de referência, gerando uma leitura precisa do pH.
O peagâmetro converte essa diferença de potencial em valores numéricos, correspondentes ao pH da solução. A leitura de pH varia de 0 a 14, dependendo da concentração de íons H+ na amostra.
Esse equipamento é amplamente utilizado em laboratórios, indústrias alimentícias, químicas, farmacêuticas e no controle ambiental. Sua importância se deve à alta precisão e capacidade de realizar medições rápidas, tornando-o essencial em processos que requerem controle rigoroso de acidez ou basicidade.
Importância do pH
O pH é importante em diversas áreas da vida cotidiana, da Biologia e da indústria. No corpo humano, o sangue possui um pH ligeiramente alcalino, em torno de 7,4, e qualquer variação significativa pode prejudicar funções vitais, como a respiração e a circulação. No meio intra e extracelular, a manutenção do pH ocorre por meio de soluções-tampão, que garantem o funcionamento do sistema biológico.
O controle do pH é também essencial no ambiente marinho, já que mudanças no pH dos oceanos podem afetar drasticamente a vida aquática, particularmente os organismos que dependem de carbonato de cálcio, a exemplo dos corais, como mostra a ilustração abaixo.

Na indústria, o pH é monitorado em processos de fabricação de produtos alimentícios, farmacêuticos e cosméticos, pois ele influencia a estabilidade e segurança dos produtos.
No meio ambiente, o pH da chuva é monitorado para prevenir a chuva ácida, que pode causar danos significativos à vegetação, ao solo e às estruturas urbanas.
O pH é uma medida fundamental na ciência, com ampla aplicação no cotidiano, na indústria e na Biologia. Entender o que é pH, como ele é calculado e sua importância em diversos contextos nos permite não apenas compreender melhor os processos químicos à nossa volta, mas também garantir o bom funcionamento de sistemas biológicos e industriais. O conhecimento do pH ajuda a controlar o ambiente em que vivemos, desde a água que bebemos até o solo em que plantamos.
Exercícios resolvidos sobre pH
Questão 1
O pH de uma solução aquosa é uma medida da sua acidez ou basicidade, sendo essencial para diferentes áreas, como Química, Biologia e meio ambiente. Qual das alternativas a seguir descreve corretamente uma solução com pH 7?
A) Solução ácida com concentração alta de íons H+
B) Solução básica com baixa concentração de íons OH⁻
C) Solução neutra, como a água pura
D) Solução básica com alta concentração de íons H+
E) Solução ácida com baixa concentração de íons H+
Resolução:
Alternativa C.
A escala de pH vai de 0 a 14, onde valores abaixo de 7 indicam soluções ácidas e valores acima de 7, soluções básicas. O pH 7 corresponde a uma solução neutra, onde a concentração de íons H+ é igual à de íons OH⁻, como na água pura.
Questão 2
Uma solução aquosa tem uma concentração de íons H+ igual a 1 × 10⁻4 mol/L. Qual é o valor aproximado do pH dessa solução?
A) 2
B) 3
C) 4
D) 5
E) 6
Resolução:
Alternativa C.
O pH é calculado pela fórmula:
pH = − log [H+]
Substituindo o valor da concentração de íons H+:
pH = − log (1 ×10−4) = 4
Portanto, o pH da solução é 4.
Questão 3
O pH de corpos d'água, como rios e lagos, é um fator crucial para a manutenção da vida aquática. Em relação a essa questão, qual das seguintes alternativas é verdadeira?
A) Um pH muito baixo pode favorecer a dissolução de nutrientes para os organismos aquáticos.
B) pH levemente ácido é sempre benéfico para a maioria dos peixes.
C) O pH elevado em rios é normalmente causado pelo aumento da acidez devido à poluição.
D) O pH muito baixo pode afetar negativamente a biodiversidade aquática, tornando a água corrosiva.
E) O pH não afeta a solubilidade de substâncias tóxicas na água.
Resolução:
Alternativa D.
Em corpos d'água, o pH baixo (ácido) pode causar a dissolução de metais pesados e afetar a vida aquática, sendo prejudicial para os organismos. Águas com pH muito baixo (ácidas) podem ser corrosivas e afetam a biodiversidade.
Fontes
ATKINS, Peter; JONES, Loretta; Princípios de química: questionando a vida moderna e o meio ambiente; 3ª ed.;Porto Alegre; Bookman; 2006.
ANDRADE, JC de. Química analítica básica: os conceitos ácido-base e a escala de pH. Rev. Chemkeys [Internet]., (1), 1-6, 2018. Disponível em: https://econtents.bc.unicamp.br/inpec/index.php/chemkeys/article/view/9642.
BROWN, Theodore L. et al. Química: a ciência central. 9.ed. São Paulo: Prentice Hall, 2005.
CHANG, Raymond; Química Geral: Conceitos Essenciais; 4ªed.; São Paulo;McGraw-Hill;2007.