Enxofre (S)
O enxofre é sólido em temperatura ambiente, de coloração amarela e aplicações diversas, que vão desde a fabricação de fertilizantes até a produção de borrachas vulcanizadas.
Por Victor Ricardo Ferreira

PUBLICIDADE
O enxofre é um sólido amarelo classificado na tabela periódica como um não metal e representa cerca de 3% da massa terrestre. É base para a síntese de ácido sulfúrico, um dos compostos mais produzidos mundialmente em escala industrial. O enxofre também está presente na constituição dos aminoácidos de plantas e animais.
Leia também: Dióxido de enxofre — um dos responsáveis pela chuva ácida
Características do enxofre
Em temperatura ambiente, o enxofre é um sólido de coloração amarela, leve, quebradiço e inodoro. É insolúvel em água, porém solúvel em dissulfeto de carbono (CS2), e é encontrado em minerais que contêm sulfitos e sulfatos, sendo reconhecido facilmente na forma de cristais amarelos. A temperatura de fusão do enxofre é 115,2 ºC, e a de ebulição, 444,7 °C, e sua densidade é 2,07 g/cm³.

O elemento químico enxofre, do latim sulphur, é representado pelo símbolo S, seu número atômico é 16, e sua massa atômica, 32,066 u. É classificado como um não metal e encontra-se na família dos calcogênios, o grupo 16 da tabela periódica.
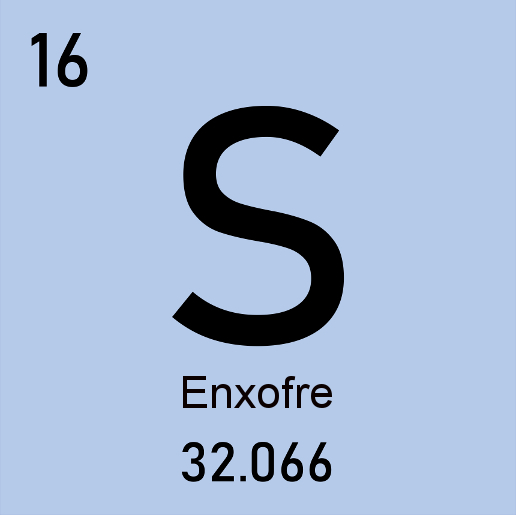
O enxofre passou a ser reconhecido como elemento químico a partir de 1789, quando o químico francês Antoine Lavoisier, considerado o pai da Química moderna, adicionou à lista dos elementos químicos.
Veja também: Lei de Lavoisier
Alotropia do enxofre
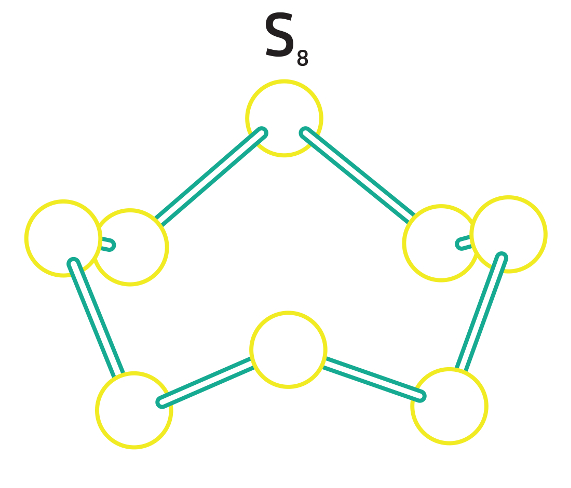
O enxofre é um dos elementos químicos que apresentam o fenômeno da alotropia e, entre eles, o que possui a maior variedade de formas alotrópicas: S2, S4, S6 e S8, que se diferenciam quanto a sua atomicidade. Esses alótropos podem ser encontrados em locais onde ocorrem erupções vulcânicas.
Os dois alótropos principais do enxofre são: o enxofre ortorrômbico (ou rômbico) e o enxofre monoclínico, ambos são formados por um anel com oito átomos de enxofre ligados (S8) e diferenciam-se quanto ao arranjo molecular, ou seja, sua estrutura..
O enxofre rômbico é um pouco mais denso que o enxofre monoclínico, possuem densidade de 2,08 g/ml e 1,96 g/ml, respectivamente. Já seu ponto de fusão é um pouco mais baixo, possuem 112,8 °C e 119,2 °C, respectivamente
Veja também: Mudanças de estado físico
Aplicações do enxofre
Uma das principais aplicações do enxofre é como reagente na produção de ácido sulfúrico (H2SO4), um dos produtos mais utilizados pelas indústrias no mundo. Além disso, possui aplicação na vulcanização de borrachas naturais e na produção de fertilizantes, papéis, pólvora, detergentes etc.
O enxofre também aparece na composição da gasolina, com uma concentração de 50 mg/kg (50 ppm, partes por milhão), o que faz com que seja liberado óxido de enxofre na atmosfera como um dos produtos da queima de combustíveis. Esses óxidos são responsáveis pela formação da chuva ácida.
Leia também: Combustão completa e incompleta
Ciclo do enxofre

O ciclo do enxofre ocorre tanto na água quanto no solo e na atmosfera. Podemos encontrar o enxofre na crosta terrestre, em maior quantidade, e na atmosfera, em menor quantidade.
O enxofre é inserido na cadeia alimentar pelas plantas, que absorvem o elemento de outras substâncias e utilizam-no para a produção de aminoácidos. No processo de decomposição das plantas e dos animais, os micro-organismos decompõem os aminoácidos e incorporam-nos nas rochas, liberando o enxofre para o meio ambiente.
Além desse caminho, o enxofre também é liberado na atmosfera pelas atividades vulcânicas e pela ação humana, por meio das atividades industriais e queimas de combustíveis dos automóveis.
É importante dizer que o aumento da liberação de compostos de enxofre, em especial os óxidos SO2 e SO3, tem desregulado o ciclo do enxofre no meio ambiente, causando graves problemas, como a intensificação das chuvas ácidas.