Solubilidade
A solubilidade é a capacidade que uma substância (soluto) tem de se dissolver em outra substância (solvente) para formar uma mistura homogênea, chamada de solução.
Por Jhonilson Pereira Gonçalves

PUBLICIDADE
A solubilidade é a capacidade de uma substância (soluto) em dissolver-se em outra (solvente) para formar uma mistura homogênea, chamada de solução. Ela é influenciada por diversos fatores, como a natureza química do soluto e do solvente, a temperatura e a pressão. Nesse sentido, a compreensão desses aspectos é essencial para prever a quantidade máxima de soluto que pode ser dissolvida em determinado solvente em condições específicas, o que é expresso frequentemente em termos de concentração da solução.
Além disso, uma das formas de determinar a solubilidade de uma substância é com base na constante de equilíbrio de solubilidade (Kps), que nos permite saber a concentração de saturação máxima de uma substância para determinada quantidade de solvente em uma pressão e temperatura específicas, antes dela começar a precipitar-se em solução. Sendo assim, neste artigo, vamos explorar um pouco dos conceitos e características dessa propriedade físico-química que é a solubilidade.
Leia também: Densidade — uma propriedade da matéria muito utilizada para identificar e caracterizar substâncias
Resumo sobre solubilidade
- A solubilidade é a capacidade de um soluto se dissolver em um solvente para formar uma solução homogênea.
- Pode ser quantificada em termos de concentração, geralmente em g/L ou mol/L.
- É influenciada por vários fatores, incluindo a natureza das substâncias, a temperatura, a pressão e a agitação.
- Existem três cenários possíveis: soluto completamente solúvel, soluto parcialmente solúvel e soluto insolúvel.
- A temperatura geralmente afeta a solubilidade, com muitos solutos se dissolvendo mais facilmente em temperaturas mais altas.
- As curvas de solubilidade são representações gráficas das mudanças na solubilidade em relação à temperatura ou pressão.
- O produto de solubilidade (Kps) é uma constante que descreve a solubilidade de compostos iônicos em soluções aquosas.
- Kps é calculado com base nas concentrações de íons presentes em uma solução saturada do composto iônico; e é uma ferramenta valiosa para prever a solubilidade de compostos iônicos, entender a formação de precipitados e otimizar reações em soluções aquosas.
O que é solubilidade?
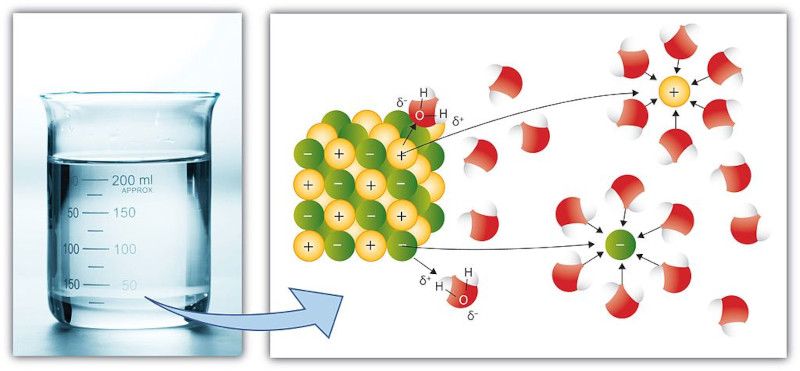
Solubilidade é a capacidade de uma substância (soluto) se dissolver em outra substância (solvente) para formar uma mistura homogênea conhecida como solução. Essa capacidade de dissolução é influenciada por diversos fatores, incluindo a natureza das substâncias envolvidas, a temperatura e a pressão. Dessa forma, verifica-se quão possível é uma substância ser dispersa em outra, de forma que seja imperceptível, a olho nu, distinguir as fases que compõem determinada mistura.
Fatores que influenciam a solubilidade
Os fatores que influenciam a solubilidade de uma substância são de natureza física e podem sofrer influência da presença de outros componentes na mistura. A seguir, veremos como cada um desses fatores ocorre.
- Polaridade: substâncias polares tendem a ser mais solúveis em solventes polares, enquanto substâncias apolares têm maior solubilidade em solventes apolares.
- Compatibilidade química: algumas substâncias têm afinidade química umas com as outras, o que pode aumentar sua solubilidade.
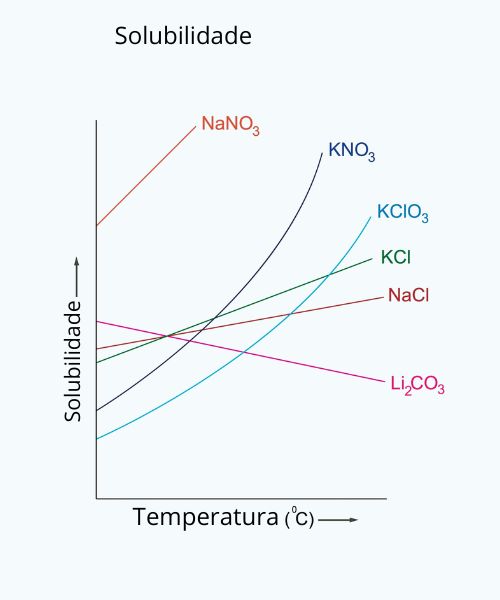
- Temperatura: em muitos casos, a solubilidade aumenta com o aumento da temperatura. Isso ocorre porque o aumento da temperatura fornece mais energia para que as partículas do soluto se dispersem no solvente. No entanto, existem exceções a essa regra, a exemplo do caso do carbonato de lítio (Li2CO3), cuja solubilidade diminui com o aumento da temperatura, como pode ser visto no gráfico de solubilidade a seguir:
- Pressão: geralmente tem um efeito insignificante na solubilidade de sólidos em líquidos, mas pode ter um impacto significativo na solubilidade de gases em líquidos. A lei de Henry descreve a relação entre a pressão de um gás e sua solubilidade em um líquido.
- Tamanho das partículas: o tamanho das partículas do soluto pode afetar a taxa de dissolução, mas não a solubilidade em si. Partículas menores têm maior área de superfície disponível para interagir com o solvente, o que pode acelerar o processo de dissolução.
- Concentração existente: em soluções saturadas, nas quais a concentração do soluto atingiu seu limite, a adição de mais soluto não resultará em aumento da solubilidade. Nesse ponto, o soluto começará a se depositar. Diante disso, na figura abaixo temos a representação esquemática da classificação de uma solução que varia de acordo com a concentração do soluto.
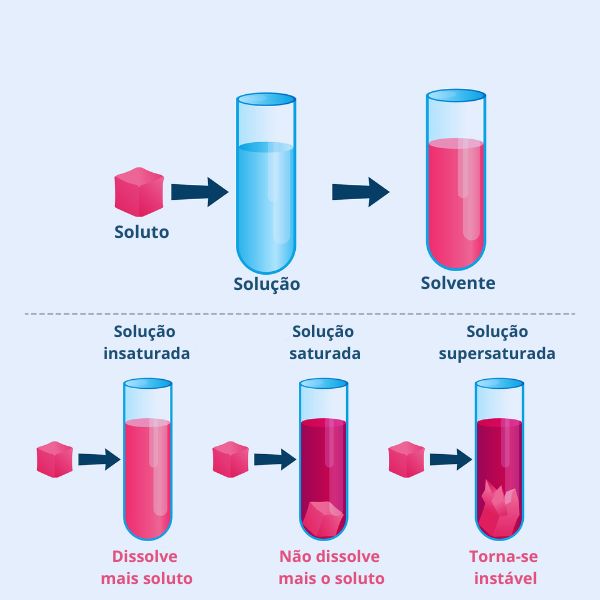
À medida que a concentração do soluto aumenta, o grau de dissolução diminui, dando início à formação de precipitados, devido à saturação da solução.
- Interferências: impurezas e outras substâncias presentes na solução podem afetar a solubilidade. Nesse caso, algumas impurezas podem aumentar ou diminuir a solubilidade do soluto.
- Agitação mecânica: a agitação mecânica, como mexer ou agitar a solução, pode acelerar o processo de dissolução, permitindo que as partículas do soluto entrem em contato mais eficientemente com o solvente.
- Efeito dos íons comuns: em soluções iônicas, a presença de íons comuns de outra fonte pode diminuir a solubilidade dos solutos iônicos. Isso ocorre porque o equilíbrio da dissolução é deslocado em direção à formação de sólidos insolúveis.
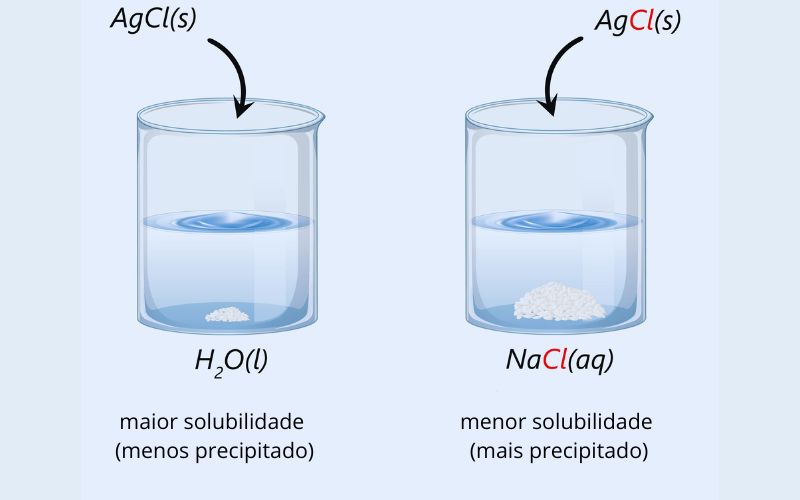
Esse efeito é ilustrado na figura acima, com o cloreto de prata (AgCl) sendo adicionado em um recipiente contendo apenas água, e o segundo recipiente contendo cloreto de sódio (NaCl) dissolvido. Como você pode perceber, ambos os sais possuem o íon cloreto (Cl-), o que dificulta a solubilização do AgCl, uma vez que se encontra saturada por íons Cl- provenientes do NaCl.
Sendo assim, a solubilidade será baixa, fazendo com que ocorra a formação de precipitados bem mais rapidamente. Nesse contexto, vale destacar que a dissolução de uma substância em um solvente não implica que ocorra uma reação química entre os dois, pois as moléculas do soluto ainda mantêm sua identidade química na solução.
Acesse também: Alguns cálculos envolvendo solubilidade
Curva de solubilidade
A curva de solubilidade é uma representação gráfica da solubilidade de uma substância em função da temperatura e, às vezes, da pressão para um solvente específico. Ela mostra como a quantidade de soluto que pode ser dissolvida em um solvente muda à medida que a temperatura (ou pressão) varia, mantendo a pressão (ou temperatura) constante. Nesse contexto, temos:
- Eixo X (temperatura): à medida que a temperatura aumenta, geralmente a solubilidade também aumenta.
- Eixo Y (solubilidade): geralmente em gramas de soluto por 100 gramas de solvente (g/100g) ou outras unidades apropriadas. Esse eixo mostra a quantidade máxima de soluto que pode ser dissolvido em uma quantidade fixa de solvente em determinada temperatura.
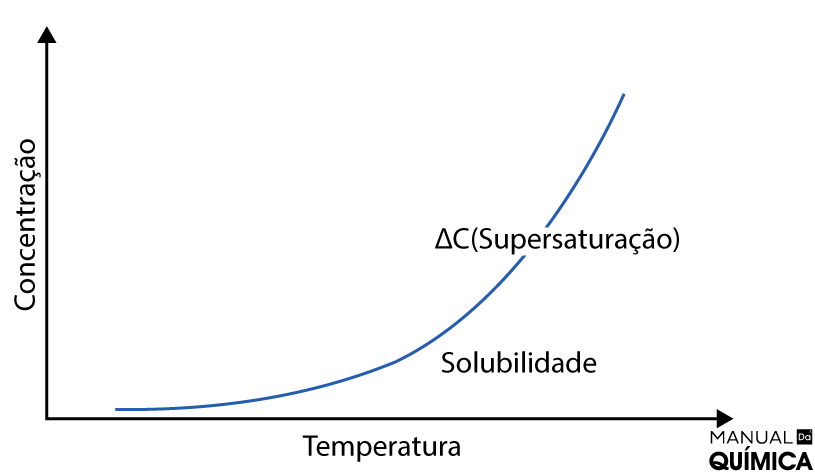
A linha da curva de solubilidade separa a região onde a solução está saturada daquela onde está insaturada. Abaixo da curva, a solução está insaturada, o que significa que mais soluto pode ser dissolvido. Na curva, a solução está saturada, o que significa que a quantidade máxima de soluto para a temperatura dada já foi dissolvida. Acima da curva, a solução está supersaturada, o que indica que há mais soluto presente do que o que deveria ser solúvel nessa temperatura.
Sendo assim, pontos específicos na curva de solubilidade podem representar pontos de interesse, como o ponto de saturação, onde a solução está saturada e não pode dissolver mais soluto sob as condições especificadas.
Vale ressaltar que, para substâncias gasosas dissolvidas em líquidos, a pressão também é um fator importante. Portanto, em alguns casos, a curva de solubilidade pode incluir a pressão no eixo horizontal.
Em resumo, a curva de solubilidade é uma ferramenta gráfica que ilustra como a solubilidade de uma substância em um solvente específico muda com a temperatura (e possivelmente com a pressão). É uma representação visual valiosa para entender as condições em que uma substância pode ser dissolvida de forma eficaz, e como a quantidade máxima que pode ser dissolvida varia com a temperatura ou a pressão.
Coeficiente de solubilidade
O coeficiente de solubilidade é uma medida quantitativa que descreve a quantidade máxima de soluto que pode ser dissolvida em determinado solvente numa temperatura e pressão específicas para formar uma solução saturada. Em outras palavras, é a forma de quantificação da solubilidade de determinada substância. Nesse sentido, essa medida é geralmente expressa em termos de concentração (como a quantidade de soluto dissolvido por unidade de volume do solvente) e é muitas vezes denotada em gramas por litro (g/L) ou mol por litro (mol/L).
Isso pode ser melhor ilustrado pelo diagrama abaixo, em que as curvas de solubilidade do nitrato de prata (KNO3) e do cloreto de potássio (KCl) mostram que a solubilidade em água (em gramas por litro) de cada sal aumenta com o aumento da temperatura.
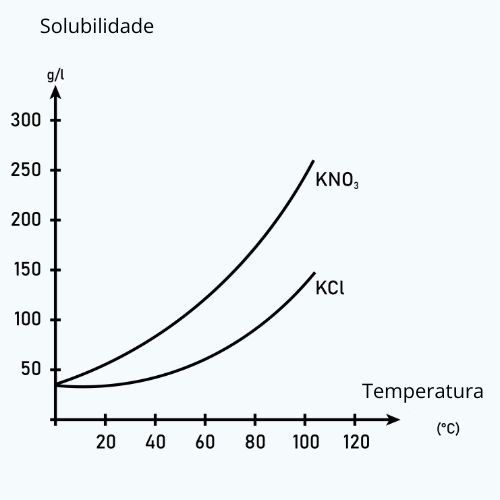
Veja que as solubilidades dos dois sais são diferentes em mesma temperatura. Além disso, é importante observar que quando o coeficiente de solubilidade aumenta com a elevação da temperatura significa que mais soluto pode ser dissolvido em um solvente quente do que em um solvente frio. No entanto, isso nem sempre é verdade para todas as substâncias, e, em alguns casos, essa medida pode diminuir com o aumento da temperatura. Nesse contexto, podemos citar dois exemplos antagônicos:
- Aumento da solubilidade com o aumento da temperatura:
- Cloreto de sódio (NaCl) em água: o cloreto de sódio, comumente conhecido como sal de cozinha, é uma substância cuja solubilidade em água aumenta à medida que a temperatura da água é elevada. Isso significa que mais sal pode se dissolver em água quente do que em água fria. O aumento da temperatura favorece o rompimento do retículo cristalino que mantém os íons de sódio (Na+) e cloro (Cl-) unidos no composto de NaCl.
- Diminuição da solubilidade com o aumento da temperatura:
- Dióxido de carbono (CO2) em água: o dióxido de carbono, um gás em temperatura ambiente, apresenta um comportamento diferente, pois sua solubilidade em água diminui à medida que a temperatura da água aumenta. Isso pode ser visto, por exemplo, quando se abre uma garrafa de refrigerante (que contém dióxido de carbono dissolvido na bebida) e ela é esquentada; o gás se desprende mais rapidamente da bebida quando ela está mais quente. A solubilidade do CO2 em bebidas não depende unicamente da temperatura, mas também da pressão exercida sobre o gás no recipiente fechado.
Esses exemplos ilustram como a solubilidade de diferentes substâncias pode variar com a temperatura, dependendo das interações entre as moléculas do soluto e do solvente. Em alguns casos, a solubilidade aumenta com o aumento da temperatura, enquanto, em outros, ela diminui. Portanto, ao determinar o coeficiente de solubilidade de uma substância, é essencial especificar as condições de temperatura e pressão nas quais a medida está sendo feita. Para saber mais detalhes sobre o coeficiente de solubilidade, clique aqui.
Como ocorre a solubilidade?
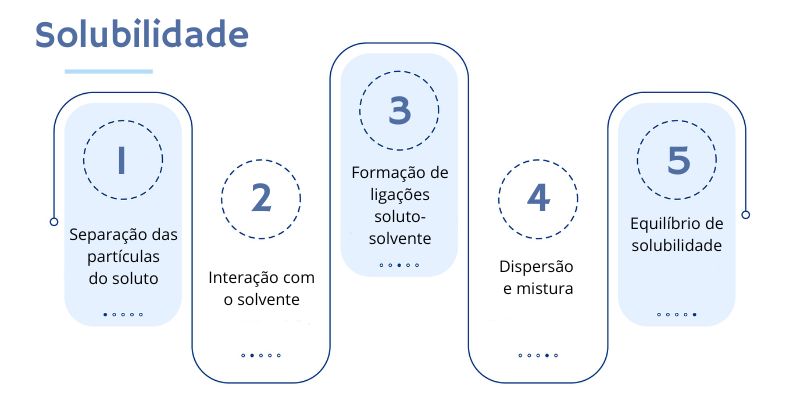
O processo de solubilidade pode ser explicado em função das etapas que envolvem a interação entre as partículas do soluto com as do solvente. Sendo assim, podemos visualizar esse processo da seguinte forma:
- Separação das partículas do soluto: para que o soluto se dissolva, as forças que mantêm as partículas do soluto juntas precisam ser superadas. Isso é geralmente alcançado quando elas absorvem energia, frequentemente na forma de calor, que quebra as ligações entre elas.
- Interação com o solvente: após a separação das partículas do soluto, elas entram em contato com as partículas do solvente. As partículas do soluto interagem com as partículas do solvente de acordo com suas propriedades químicas. Se o soluto e o solvente compartilham características semelhantes, como polaridade, as interações entre eles serão mais favoráveis.
- Formação de ligações soluto-solvente: quando as partículas do soluto interagem com as do solvente, podem ocorrer atrações intermoleculares, como ligações de hidrogênio ou forças dipolo-dipolo, dependendo das propriedades das substâncias envolvidas. Quanto mais forte a interação entre o soluto e o solvente, mais fácil é a dissolução.
- Dispersão e mistura: à medida que as partículas do soluto se misturam com as do solvente, a solução começa a se formar. Sendo assim, as partículas do soluto são gradualmente dispersas pelo solvente, resultando em uma mistura homogênea. A agitação mecânica, como mexer ou agitar, ajuda a acelerar esse processo, permitindo que as partículas do soluto entrem em contato mais eficazmente com as do solvente.
- Equilíbrio de solubilidade: à medida que a dissolução prossegue, a concentração do soluto na solução aumenta. Eventualmente, um ponto de equilíbrio é alcançado, onde a taxa de dissolução do soluto é igual à taxa de precipitação, ou seja, a taxa na qual o soluto está se dissolvendo é igual à taxa na qual ele está se separando da solução. Isso marca o ponto em que a solução se torna saturada e a solubilidade máxima foi alcançada para as condições específicas de temperatura e pressão.
Portanto, a solubilidade é um processo dinâmico em que várias etapas ocorrem à medida que o soluto se dissolve no solvente. A capacidade de dissolução de um soluto em um solvente depende da natureza das substâncias envolvidas, bem como das condições de temperatura e pressão.
Produto da solubilidade
O produto de solubilidade (Kps) é uma constante de equilíbrio que descreve a solubilidade de compostos iônicos em solução aquosa. Nesse sentido, refere-se ao produto das concentrações de íons presentes em uma solução saturada de um composto iônico, no ponto em que a solução está saturada e o sólido começa a se precipitar, alcançando o equilíbrio químico. Sendo assim, o produto de solubilidade (Kps) é uma medida da tendência de um composto iônico de se dissolver em uma solução.
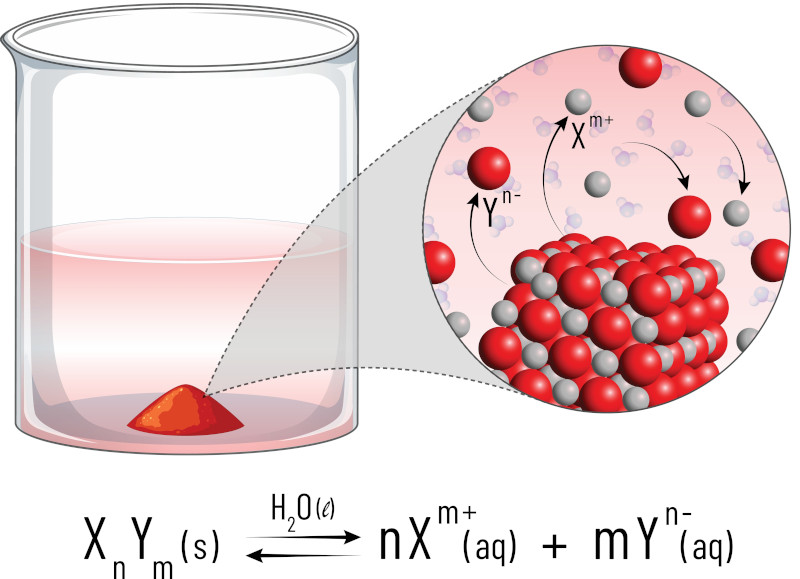
Para entender melhor esse conceito, primeiro deve-se saber que sólidos e líquidos não aparecem na expressão de equilíbrio devido às suas concentrações serem constantes. Sendo assim, o produto de solubilidade (Kps) é calculado em função das concentrações das espécies iônicas em solução. A fórmula geral do produto de solubilidade para um composto iônico AB é dada por:
Kps = [A+]m[B-]n
- [A+] e [B-] → concentrações das espécies iônicas A+ e B- na solução saturada.
- m e n → coeficientes estequiométricos dos íons na equação química balanceada que descreve a dissolução do composto.
Aqui estão alguns exemplos práticos:
- Cloreto de prata (AgCl): a dissolução do cloreto de prata em água é descrita pela equação química:
AgCl(s) ⇌ Ag⁺(aq) + Cl⁻(aq)
O produto de solubilidade (Kps) para o cloreto de prata é dado por:
Kps = [Ag⁺][Cl⁻]
- Sulfato de cálcio (CaSO4): a dissolução do sulfato de cálcio em água é descrita pela equação química:
CaSO₄(s) ⇌ Ca²⁺(aq) + SO₄²⁻(aq)
O Kps para o sulfato de cálcio é dado por:
Kps = [Ca²⁺][SO₄²⁻]
- Hidróxido de cálcio (Ca(OH)2): a dissolução do hidróxido de cálcio em água é descrita pela equação química:
Ca(OH)₂(s) ⇌ Ca²⁺(aq) + 2OH⁻(aq)
O Kps para o hidróxido de cálcio é dado por:
Kps = [Ca²⁺][OH⁻]²
Diante disso, vale ressaltar que o valor específico do produto de solubilidade (Kps) varia para cada composto iônico e é determinado experimentalmente. Quando a concentração dos íons em uma solução atinge ou excede o valor de Kps, o composto começa a se precipitar, indicando que a solução está saturada. Por outro lado, se a concentração dos íons for menor do que o valor do produto de solubilidade (Kps), a solução é insaturada, e mais composto pode se dissolver.
A seguir, temos uma tabela|1| do produto de solubilidade (Kps) para alguns compostos:
|
Composto |
Produto de solubilidade (Kps) |
|
Al(OH)3 |
3 x 10-34 |
|
BaSO4 |
1,1 x 10-10 |
|
CaF2 |
3,9 x 10-11 |
|
CaSO4 |
6,5 x 10-6 |
|
CuS |
8 x 10-37 |
|
Fe(OH)2 |
4,1 x 10-15 |
|
PbCO3 |
7,4 x 10-14 |
Cabe ressaltar que, quanto maior o valor de produto de solubilidade (Kps), maior a solubilidade do soluto. Sendo assim, na tabela, tem-se o sulfato de cálcio (CaSO4) sendo o mais solúvel dos compostos apresentados.
Ressalta-se que o produto de solubilidade (Kps) é uma ferramenta importante na Química para prever a solubilidade de compostos iônicos, entender a formação de precipitados e otimizar reações químicas em soluções aquosas.
Importante: Em todos os casos citados neste artigo, levamos em consideração a solubilidade dos compostos em água.
Para saber mais detalhes sobre o produto de solubilidade (Kps), clique aqui.
Exercícios resolvidos sobre solubilidade
Questão 1
(Uece) O conhecimento da solubilidade é importante em preparações industriais e laboratoriais e, na medicina, para o estudo dos cálculos renais. O estudo da solubilidade também explica, entre outras coisas, a formação de estalactites e a poluição térmica em cursos de água. No que concerne à solubilidade ou ao produto de solubilidade, assinale a afirmação verdadeira.
A) A solubilidade e o produto de solubilidade sempre se referem a soluções insaturadas.
B) A solubilidade de um gás em água sempre aumenta com a temperatura.
C) O produto de solubilidade é uma constante de equilíbrio.
D) Todos os processos de dissolução de sais são exotérmicos.
Resolução:
Alternativa C
O produto de solubilidade Kps é uma constante de equilíbrio que descreve a solubilidade de compostos iônicos em solução aquosa. Quando o produto das concentrações das espécies iônicas do soluto na solução é maior que o Kps, a solução fica supersaturada, dando início à formação de precipitados.
Questão 2
(UFRRJ)
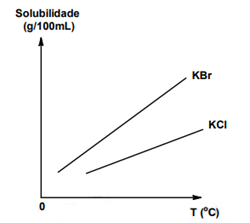
Ao analisar o gráfico acima, percebe-se que:
a) a solubilidade do KCl é maior que a do KBr.
b) à medida que a temperatura aumenta, a solubilidade diminui.
c) a solubilidade do KBr é maior que a do KCl.
d) quanto menor a temperatura, maior a solubilidade.
e) o KCl apresenta solubilização exotérmica.
Resolução:
Alternativa C
Ao analisar o gráfico, percebe-se que a curva de solubilidade do KBr está acima da curva do KCl, o que significa que a solubilidade do KBr é maior que a do KCl para a mesma temperatura.
Nota
|1| SKOOG, D. A. et al. Fundamentos de Química Analítica. 8a ed. [s.l.] Cengage Learning Brasil, 2013.
Crédito de imagem
[1] Andy Schmitz / Wikimedia Commons (reprodução)
Fontes
GONÇALVES, D. B. et al. PREPARO DE SOLUÇÕES. In: Práticas em bioquímica analítica. [s.l: s.n.]. p. 13–17.
L. BROWN, T. et al. Soluções saturadas e solubilidade. In: Química: A Ciência Central. 13. ed. São Paulo: Pearson Education do Brasil, 2016. p. 558–570.
SKOOG, D. A. et al. Fundamentos de Química Analítica. 8a ed. [s.l.] Cengage Learning Brasil, 2013.