Prótons
O próton foi a segunda partícula subatômica a ser descoberta. Possui carga igual à de um elétron, só que positiva, e massa de 1,673 x 10-27.
Por Laysa Bernardes Marques de Araújo
PUBLICIDADE
O próton foi a segunda partícula subatômica a ser descoberta. Os estudos sobre essa partícula começaram em 1886 por Eugen Goldstein, no entanto foi Ernest Rutherford que a registrou como próton, que significa primário.
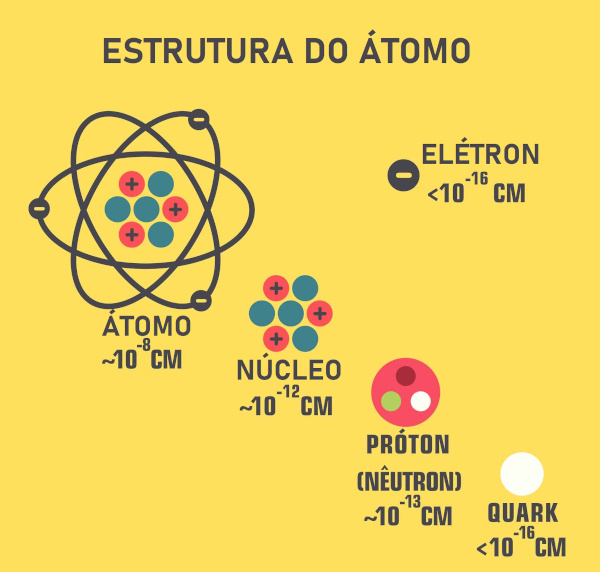
Os prótons ficam localizados no núcleo do átomo, possuem carga de 1,6.10-19 coulombs e massa de 1,673.10-24g. A massa de um átomo é dada basicamente pela soma do peso dos nêutrons e prótons presentes.
Leia também: Íons – espécies químicas que possuem carga elétrica
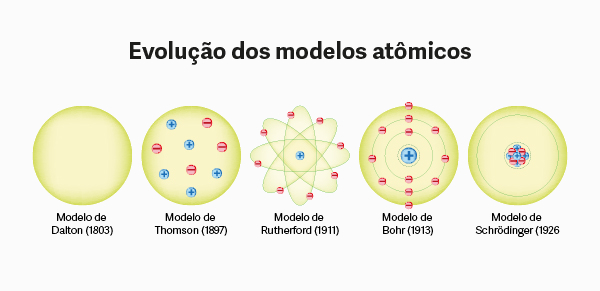
Descoberta do próton
O próton foi a segunda partícula subatômica descoberta. Começou a ser estudada em 1886 por Eugen Goldstein, que utilizou a ampola de Crookes para isso, mesmo aparato utilizado por Thomson para a evidenciar a descoberta do elétron.
Goldsteim fez furos na placa de cátodo da ampola e observou feixes luminosos que atravessavam em sentido contrário aos raios catódicos (luminosidade provocada pelos elétrons). Esses raios que iam na direção contrária foram chamados de raios canais.
Depois da observação da existência de uma partícula ainda não conhecida, ele aprofundou as investigações, buscando experimentalmente outras características dos raios canais. Foi colocado então um campo elétrico na ampola de Crookes para estudar se os novos raios eram carregados positiva ou negativamente. Nesse momento, descobriu-se que eles eram atraídos pelo campo negativo, portanto eram carregados com carga positiva.
Posteriormente, Goldstein, ainda em estudo do que ele chamava de raios canais, descobriu que essas partículas resultavam de uma colisão entre as moléculas de H2 com os elétrons.
Apesar de todas as descobertas feitas por Eugen Goldsteim, quem nomeou e concluiu os estudos sobre a partícula foi o neozelandês Ernest Rutherford, após constatar que os raios canais provindos do hidrogênio tinham a menor carga positiva estudada até então. Assim, deu à partícula o nome de próton, que significa “primário” no grego.
Leia também: Modelo atômico de Thomson – esfera carregada positivamente com elétrons incrustados
Onde se localizam os prótons?
Os prótons são partículas subatômicas, ou seja, são partes de um átomo. Estão localizados no núcleo atômico, junto com os nêutrons, e ambos são cobertos ou rodeados pela eletrosfera, que é onde ficam os elétrons.
Característica dos prótons
Os prótons possuem carga de 1,6.10−19 coulombs, mesma intensidade da carga de um elétron, só que com sinal oposto. Sua massa é 1,673.10-24g, o que é 1836 vezes maior que a massa de um elétron e ligeiramente mais leve que um nêutron.

Número de massa (A)
Informações sobre número de massa de um elemento químico podem ser encontradas na tabela periódica, no canto inferior da representação do elemento. Para representação fora da tabela, é dado o número de massa no canto superior do elemento (AX ou XA). A informação é dada em u, que significa unidade de massa atômica. Podemos também fazer a seguinte relação matemática:
A = Z + N
Ou seja, a massa de um elemento é dada basicamente pela somatória das massas dos prótons e nêutrons, visto que os elétrons e quarks não têm peso significativo.
Veja também: Organização da tabela periódica: famílias e períodos
Número atômico (Z)
O número atômico de um elemento são os prótons que ele carrega ou o número de cargas positivas presentes no núcleo do um elemento químico. Cada elemento tem um número atômico que o define. Essa é uma informação elementar e pode ser encontrada na tabela periódica, logo acima do símbolo de cada elemento. Para representações fora da tabela periódica, ela aparece no cando inferior esquerdo do elemento (ZX). Pode também ser calculado, como no caso do número da massa e pela mesma sentença:
Z = N – A
Elementos em estado fundamental ou que não estejam carregados (elementos neutros) têm número atômico igual ao número de elétrons, ou seja, número de cargas positivas igual ao número de cargas negativas.
Exercícios resolvidos
Questão 1- (Fuvest) O átomo constituído de 17 prótons, 18 nêutrons e 17 elétrons possui número atômico e número de massa iguais a:
A) 17 e 17
B) 17 e 18
C) 18 e 17
D) 17 e 35
E) 35 e 17
Resolução
Alternativa D.
Sabendo que número atômico é igual ao número de prótons de um elemento e tendo em mente a equação que relaciona as três propriedades do átomo em questão (número de massa, prótons e nêutrons), podemos calcular o número de massa a partir das informações dadas pelo enunciado.
A = Z + N
A = 17 + 18
A = 35 u
Assim sendo, número atômico é 17 e número de massa é 35 u.
Questão 2 - (UEMG) O desenvolvimento científico e tecnológico possibilitou a identificação de átomos dos elementos químicos naturais e também possibilitou a síntese de átomos de elementos químicos não encontrados na superfície da Terra. Indique, entre as alternativas abaixo, aquela que identifica o átomo de um determinado elemento químico e o diferencia de todos os outros.
A) Massa atômica
B) Número de elétrons
C) Número atômico
D) Número de nêutrons
Resolução
Alternativa C. O número atômico é uma propriedade inerente a uma espécie. Podemos ter diferentes elementos com mesmo número de massa (isóbaros) ou mesmo número de nêutrons (isótonos), mas nunca elementos diferentes com mesmo número atômico. É possível encontrar também o mesmo elemento com massa atômica diferente, processo chamado de isotopia (isótopos).
Questão 3 - (FUCMT) O íon de ²³11Na+ contém:
A) 11 prótons, 11 elétrons e 11 nêutrons.
B) 10 prótons, 11 elétrons e 12 nêutrons.
C) 23 prótons, 10 elétrons e 12 nêutrons.
D) 11 prótons, 10 elétrons e 12 nêutrons.
E) 10 prótons, 10 elétrons e 23 nêutrons.
Resolução
Alternativa D.
A representação e o posicionamento das informações dadas pela questão estão de acordo com o que estabelece a União da Química Pura e Aplicada (IUPAC), portanto o sódio (Na) possui 11 prótons, 23 de número de massa e uma carga positiva, o que quer dizer que ele possui os elétrons originais do elemento (n° de -e = n° de prótons) menos 1: 10 elétrons.
Sobre o número de nêutrons, vamos usar a equação A= Z + N para calcularmos:
A= Z + N
23 = 11 + N
N = 23 – 11
N = 12
Portanto, temos: 11 prótons, 10 elétrons e 12 nêutrons.