Modelo atômico de Rutherford
Rutherford chegou à conclusão de que o átomo teria um núcleo pequeno, denso e positivo, além de elétrons girando ao redor do núcleo em uma região vazia chamada eletrosfera.
Por Jennifer Rocha Vargas Fogaça

PUBLICIDADE
No ano de 1911, o físico neozelandês Ernest Rutherford conduziu um experimento muito importante que mudou o modo como o átomo era visto pelos cientistas da época. Até o momento, o modelo atômico aceito era o de Thomson, que dizia que o átomo seria uma esfera positiva, não maciça, incrustada de elétrons e com carga elétrica total nula.
O experimento em questão é demonstrado na figura abaixo, onde temos uma amostra do elemento radioativo polônio dentro de um bloco de chumbo. A radiação alfa (α) que saía do polônio passava por um pequeno orifício do bloco de chumbo e ia em direção a uma finíssima lâmina de ouro. Atrás dessa lâmina de ouro havia um anteparo fluorescente, pois foi recoberto de sulfeto de zinco, que mostraria uma luminosidade onde as partículas alfa incidissem.
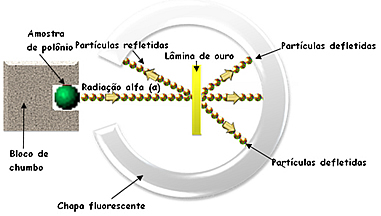
Experimento de Rutherford com partículas alfa em lâmina de ouro
O resultado observado foi o seguinte:
-
A maioria das partículas continuou sua trajetória atravessando a lâmina de ouro;
-
Poucas partículas atravessaram a lâmina e desviaram-se de sua trajetória;
-
Poucas partículas foram refletidas, não atravessando a lâmina.
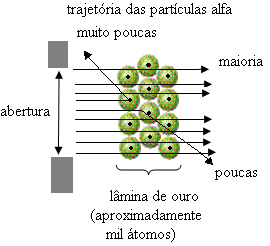
Trajetória das partículas alfa no experimento de Rutherford
Cada um desses fatos levou Rutherford à conclusão de que o modelo de Thomson estava incorreto:
-
O fato de a grande maioria das partículas alfa atravessar a lâmina de ouro indica que a maior parte do átomo trata-se, na verdade, de espaços vazios;
-
O fato de poucas partículas que atravessaram a lâmina de ouro terem sofrido um desvio na sua trajetória indica que elas se aproximavam de alguma região do átomo que tivesse a mesma carga que elas, isto é, carga positiva, sendo assim repelidas;
Não pare agora... Tem mais depois da publicidade ;) -
As poucas partículas que foram rebatidas pela lâmina de ouro indicavam que o átomo possui uma região maciça que impedia essa passagem, com carga igual, isto é, positiva. As partículas refletidas bateriam de frente com essa região.
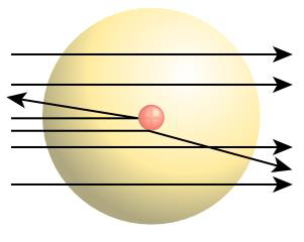
Explicação do experimento de Rutherford e modelo do átomo
Essas observações levaram Rutherford a criar um novo modelo atômico:
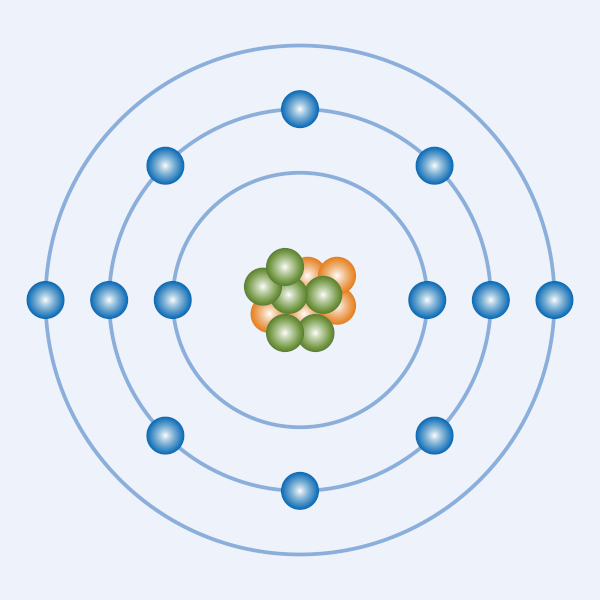
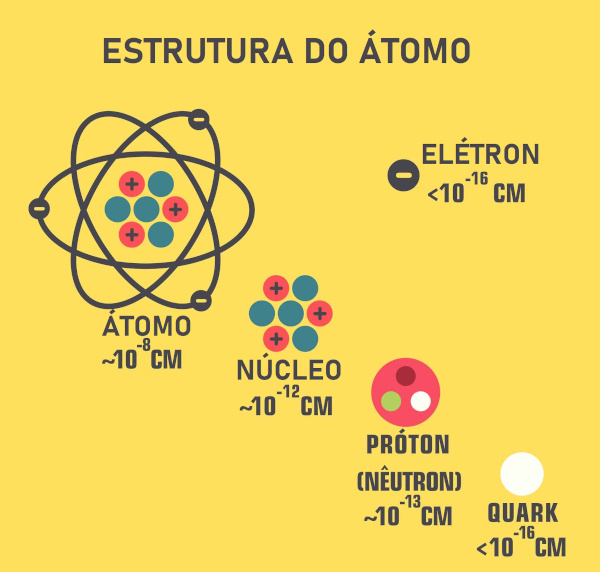
Modelo atômico de Rutherford: O átomo possui uma região central chamada de núcleo atômico, onde fica praticamente toda a massa do átomo e que apresenta carga positiva, e uma região denominada de eletrosfera, onde os elétrons ficam girando ao redor do núcleo.
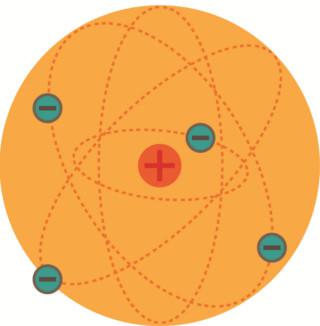
Modelo do átomo de Rutherford
Esse modelo de Rutherford ficou conhecido como sistema planetário ou sistema solar, porque o Sol seria o núcleo, enquanto os planetas seriam os elétrons que ficam girando ao redor.
Alguns anos mais tarde a terceira partícula subatômica (nêutron) foi descoberta e alterou-se um pouco o modelo de Rutherford. O núcleo atômico era composto pelos prótons (partículas positivas) e nêutrons (partículas neutras), compondo quase que a massa total do átomo:
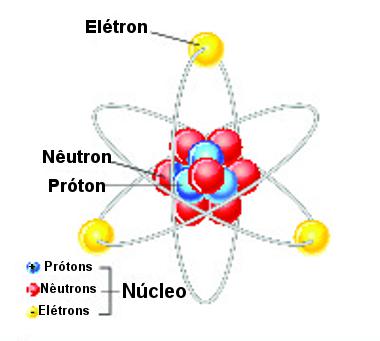
Átomo com núcleo formado por prótons e nêutrons com elétrons girando na eletrosfera
Por Jennifer Fogaça
Graduada em Química