Transformação isobárica
A transformação isobárica ocorre quando uma massa fixa de determinado gás sofre variação no volume e na temperatura, mas a pressão mantém-se constante.
Por Jennifer Rocha Vargas Fogaça

PUBLICIDADE
As transformações gasosas sempre ocorrem com uma das variáveis de estado dos gases mantida constante, enquanto as demais sofrem variação. No caso da transformação isobárica, a variável que permanece constante é a pressão (P), já a temperatura e o volume variam.
Imagine que coloquemos uma bexiga vazia na boca de uma garrafa PET. Se mergulharmos essa garrafa em um recipiente com água quente, a bexiga inflará. Por outro lado, se colocarmos a garrafa em contato com água gelada, a bexiga murchará.
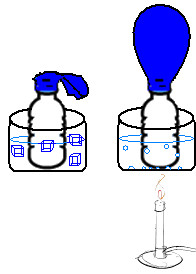
Experimento de balão na garrafa para demonstrar a relação entre temperatura e volume
Nesse experimento, a pressão manteve-se contante, mas quando aumentamos a temperatura (água quente), o volume da mistura gasosa (ar) dentro da garrafa PET também aumentou, ou seja, expandiu-se e fez o balão inflar. O contrário aconteceu quando diminuímos a temperatura (água gelada), isto é, a mistura gasosa contraiu-se e o volume ocupado por ela diminuiu.
Esse é um exemplo de transformação isobárica e mostra-nos o seguinte:
“Em um sistema sob pressão contante, observa-se que o volume ocupado por determinada massa fixa de gás é diretamente proporcional à temperatura termodinâmica.”
Essa lei é conhecida por primeira lei de Charles e Gay-Lussac, pois ela foi inicialmente observada em 1787 pelo físico francês Jacques Charles (1746-1823) e, em 1802, foi quantificada pelo químico francês Joseph Gay-Lussac (1778-1850).
Essa quantificação mostrou que se aumentarmos a temperatura para o dobro do seu valor inicial, o volume também aumentará exatamente o dobro, e se diminuirmos pela metade a temperatura, o volume ocupado pelo gás também diminuirá a metade. É importante ressaltar que isso só vale se a temperatura for a termodinâmica, isto é, na escala Kelvin.
Isso acontece porque o aumento da temperatura eleva também a energia cinética das moléculas ou átomos do gás, o que faz com que elas movimentem-se ainda mais rapidamente, expandindo o volume. Mas quando a temperatura diminui, as partículas constituintes do gás movimentam-se mais lentamente, e o gás contrai-se.
Sempre que duas grandezas são diretamente proporcionais, matematicamente temos que a razão entre elas é igual a uma constante:
V = k
T
Para verificar se isso é verdade, considere os dados mostrados na tabela a seguir que foram obtidos em transformações isobáricas:
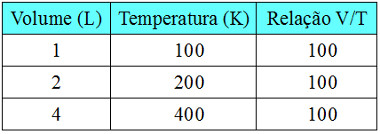
Dados obtidos em transformação isobárica
Colocando os dados mostrados acima em um gráfico, temos o seguinte:
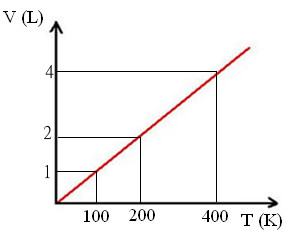
Gráfico de transformação isobárica segundo a lei de Charles e Gay-Lussac
Em todos os gráficos de transformações isobáricas, obtemos uma reta, pois o volume varia proporcionalmente com a temperatura e vice-versa.
Observe que o volume e a temperatura aumentaram proporcionalmente e que a relação V/T deu o mesmo valor em todos os casos, ou seja, é uma constante. Com base nisso, podemos representar essa relação também da seguinte forma:
Vinicial = Vfinal
Tinicial Tfinal
Veja agora um exemplo de como podemos usar essa relação matemática para resolver problemas relacionados com transformações gasosas:
Exemplo: “(UnB-DF) Um volume igual a 30 mL de gás metano a 25ºC é aquecido a 35ºC, à pressão constante. Calcule o novo volume do gás.”
Resolução:
Dados:
Tinicial = 25º C + 273 = 298 K
Tfinal = 35º C + 273 = 308 K
Vinicial = 30 mL
Vfinal = ?
Aplicando na fórmula, temos:
Vinicial = Vfinal
Tinicial Tfinal
30 = Vfinal
298 308
Vfinal = 30 . 308
298
Vfinal = 31 mL
Esse é o volume novo ocupado pelo gás com o aumento da temperatura.
Por Jennifer Fogaça
Graduada em Química