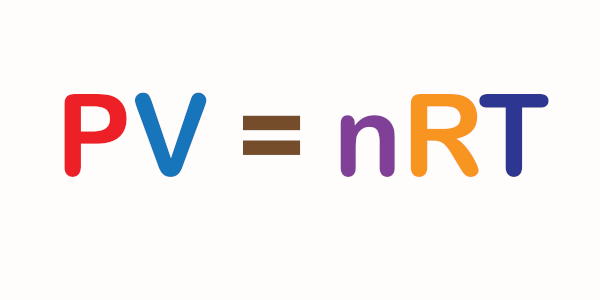Transformação isocórica ou isovolumétrica
A transformação isocórica acontece quando uma massa fixa de determinado gás sofre variação na pressão e na temperatura, mantendo-se o volume constante.
Por Jennifer Rocha Vargas Fogaça
PUBLICIDADE
A transformação isocórica, também chamada de isovolumétrica ou isométrica, é um tipo de transformação gasosa em que se mantém o volume constante e ocorre a variação da temperatura e da pressão.
Por exemplo, imagine uma lata do tipo spray. Em seu rótulo é dito que não se deve incinerá-la. Por que não podemos fazer isso? Bem, se aumentarmos a temperatura da latinha por queimá-la, os resíduos de gases que ainda restam dentro dela causarão uma maior pressão e ela explodirá.
Esse caso é um exemplo de transformação isocórica, pois o volume dentro da lata manteve-se contante, mas a temperatura foi elevada, o que causou um aumento na pressão também. Isso acontece porque o aumento da temperatura aumenta a energia cinética média das partículas, fazendo com que elas movimentem-se em uma velocidade maior e expandam-se. Porém, como o volume não aumenta, pois ele está constante, essas partículas colidem ainda mais com as paredes do recipiente, causando uma maior pressão.
Por outro lado, se a temperatura abaixar, as partículas constituintes dos gases movimentar-se-ão mais devagar e, com isso, a pressão também diminuirá.
Esse tipo de transformação gasosa foi estudada de forma independente pelos cientistas Jacques Alexandre César Charles (1746-1823) e Joseph Louis Gay-Lussac (1778-1850). Eles chegaram à seguinte conclusão, que é conhecida como segunda lei de Charles e Gay-Lussac:
“Em um sistema com volume contante, observa-se que a pressão exercida por determinada massa fixa de gás é diretamente proporcional à temperatura termodinâmica.”
Duas grandezas são diretamente proporcionais quando o quociente entre elas é igual a uma constante. Assim, matematicamente, temos:
P = k
T
Para verificar como isso é verdade, veja os dados obtidos em transformações isovolumétricas que estão listados na tabela a seguir:
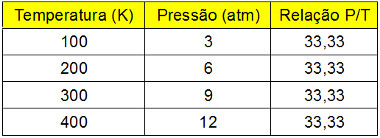
Tabela com valores de variação de temperatura e pressão em transformação isocórica
Veja que a pressão aumenta proporcionalmente com o aumento da temperatura na escala kelvin (não pode ser em outra escala termométrica). Além disso, a relação P/T sempre resulta no mesmo valor, ou seja, é uma constante. Se colocarmos esses valores em um gráfico, obteremos uma reta:
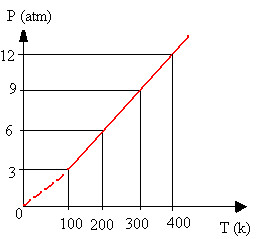
Gráfico de transformação isocórica ou isovolumétrica
Visto que o valor do quociente da pressão pela temperatura sempre dá o mesmo valor, podemos estabelecer a seguinte relação matemática:
Pinicial = Pfinal
Tinicial Tfinal
Observe como usar essa fórmula para resolver um problema sobre transformação gasosa:
Exemplo: (UFF-RJ) Num recipiente com 12,5 mL de capacidade, está contida certa amostra gasosa cuja massa exercia uma pressão de 685,0 mmHg, à temperatura de 22°C. Quando esse recipiente foi transportado com as mãos, sua temperatura elevou-se para 37°C e a pressão exercida pela massa gasosa passou a ser, aproximadamente:
a) 0,24 atm
b) 0,48 atm
c) 0,95 atm
d) 1,50 atm
e) 2,00 atm
Resolução:
Dados:
V = constante em 12,5 mL
Tinicial = 22ºC + 273 = 295 K
Tfinal = 37ºC + 273 = 310 K
Pinicial = 685,0 mmHg
Pfinal = ?
* Aplicando esses valores na fórmula, temos:
Pinicial = Pfinal
Tinicial Tfinal
685,0 = Pfinal
295 310
Pfinal = 685,0 . 310
295
Pfinal = 719,83 mmHg
* Agora vamos passar a pressão para atm. A relação entre essas duas grandezas é mostrada no texto Pressão – uma variável de estado dos gases.
1 atm ----- 760 mmHg
x --------719,83 mmHg
x = 719,83 mmHg . 1 atm
760 mmHg
x ≈ 0,95 atm.
A alternativa correta é a letra “c”.
Por Jennifer Fogaça
Graduada em Química