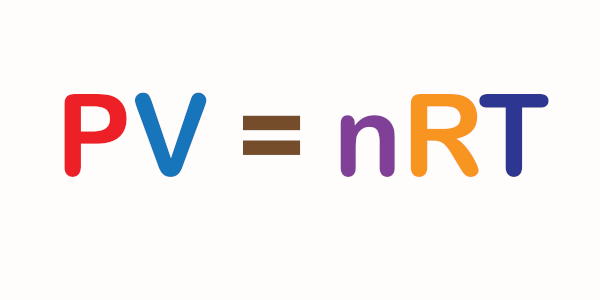Transformações gasosas
As três transformações gasosas são: transformação isotérmica, isobárica e isocórica ou isovolumétrica.
Por Jennifer Rocha Vargas Fogaça

PUBLICIDADE
Existem três grandezas que definem o comportamento ou o estado dos gases, que são a pressão, o volume e a temperatura. Elas são chamadas de variáveis de estado dos gases. Se pelo menos uma dessas grandezas passar por alguma alteração, dizemos então que o gás sofreu uma transformação gasosa ou uma mudança de estado.
Para entender como essas variáveis de estado relacionam-se, os cientistas realizaram experimentos em sistemas fechados, ou seja, em que não há troca de massa com o meio ambiente, mas pode haver trocas de calor, e eles passaram a manter uma das variáveis de estado constantes enquanto variavam as duas outras e verificavam como a alteração de um influenciava na variação da outra.
Desse modo, existem três transformações gasosas principais, que são descritas a seguir:
1. Transformação isotérmica: Nessa transformação a temperatura é mantida constante e há variação da pressão e do volume. Os cientistas que estudaram esse tipo de transformação de modo independente foram o físico e naturalista inglês Robert Boyle (1627-1691) e o físico francês Edme Mariotte (1620-1684).

Robert Boyle (1627-1691)
Por isso, a lei que elucida o que acontece nas transformações isotérmicas é conhecida como Lei de Boyle-Mariotte e diz o seguinte:
“Com a temperatura sendo mantida constante, a massa de determinado gás ocupa um volume inversamente proporcional à sua pressão.”
Isso quer dizer que se aumentamos a pressão sobre um gás, o seu volume diminuirá e vice-versa. Por exemplo, se pegarmos uma seringa cheia de ar, fecharmos a extremidade com um dedo e depois empurrarmos o êmbolo, estaremos aumentando a pressão e observaremos que o volume ocupado pelo ar dentro da seringa irá diminuir.
A fórmula matemática que expressa a transformação isotérmica é dada por: P.V = k, porque quando duas grandezas como essas são inversamente proporcionais, o seu produto é sempre uma constante. Por isso, temos também que: Pinicial . Vinicial = Pfinal . Vfinal.
A representação das transformações isotérmicas em gráficos sempre resulta em uma curva, que é uma hipérbole chamada de isoterma:
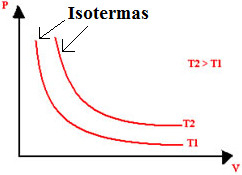
Representação gráfica de isotermas
2. Transformação isobárica: Nessa transformação a pressão é mantida constante e há variação da temperatura e do volume. Os cientistas que estudaram esse tipo de transformação de modo independente foram Jacques Charles (1746-1823), em 1787, e, depois, no ano de 1802, Joseph Gay-Lussac (1778-1850).

Charles e Gay-Lussac estudaram as transformações isobáricas
Visto que eles também estudaram a próxima transformação gasosa que iremos mencionar, a lei que expressa o que ocorre na transformação isobárica é conhecida como Primeira Lei de Charles/Gay-Lussac. Essa lei diz o seguinte:
“Com a pressão sendo mantida constante, a massa de determinado gás ocupa um volume diretamente proporcional à sua temperatura termodinâmica.”
Isso quer dizer que se aumentarmos a temperatura de uma massa fixa de gás, o seu volume também irá aumentar e vice-versa.
Isso pode ser representado matematicamente por:
V = k
T
E também por:
Vinicial = Vfinal
Tinicial Tfinal
A representação gráfica das transformações isobáricas sempre resulta em retas, como mostrado abaixo:
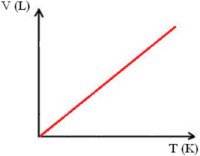
Representação gráfica de transformação isobárica
3. Transformação isocórica ou isovolumétrica: Nessa transformação o volume é mantido constante e há variação da temperatura e da pressão.
A Segunda Lei de Charles/Gay-Lussac, que é sobre as transformações isocóricas, diz:
“Com o volume sendo mantido constante, a massa de determinado gás exerce uma pressão diretamente proporcional à sua temperatura termodinâmica.”
Isso quer dizer que se aumentamos a temperatura de uma massa fixa de gás, a sua pressão também aumentará e vice-versa.
Isso pode ser representado matematicamente por:
P = k ou Pinicial = Vfinal
T Tinicial Tfinal
Assim como ocorre nas transformações isobáricas, a representação gráfica das transformações isocóricas, em que temos a relação Pressão x Temperatura, dará como resultado também uma reta:
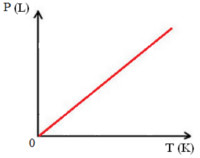
Representação gráfica de transformação isocórica
Observação: Nas transformações gasosas, a temperatura sempre deve ser considerada na escala absoluta (temperatura medida em kelvin).
Por Jennifer Fogaça
Graduada em Química