Catalisador
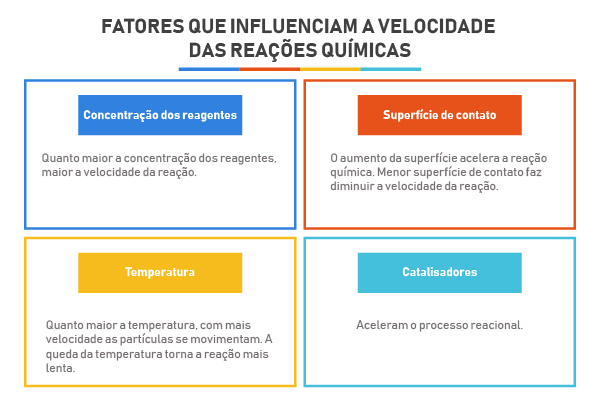
Um catalisador é uma substância capaz de acelerar uma reação sem sofrer alteração, isto é, não é consumido durante a reação.
Por Jennifer Rocha Vargas Fogaça
PUBLICIDADE
Um catalisador é uma substância capaz de acelerar a velocidade em que se processam determinadas reações químicas sem sofrer alterações, ou seja, não é consumido, mas regenera-se completamente no final.
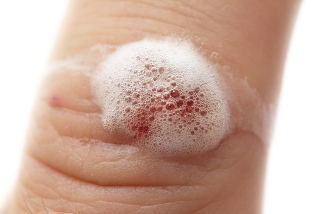
A água oxigenada (solução aquosa de peróxido de hidrogênio — H2O2), por exemplo, sofre uma decomposição bem lenta em condições ambientes, formando o gás oxigênio e a água, conforme a equação química a seguir:
2 H2O2 → 2 H2O + 1 O2
Essa reação é acelerada quando a água oxigenada é colocada sobre algum machucado. Isso pode ser visto por meio das bolhas que se formam pela formação intensa do gás oxigênio. O que aumentou a velocidade dessa reação? Um catalisador biológico, também chamado de biocatalisador, que é uma enzima presente no sangue denominada catalase.
A reação que ocorre na presença de um catalisador é chamada de catálise. Nas equações químicas que representam essas reações, o catalisador é indicado através de uma seta, tendo em vista que ele não participa nem como reagente nem como produto.
O processo de fabricação da amônia, que é chamado de Haber-Bosch, usa o ferro como catalisador. Além dele, também são usados o óxido de potássio e o óxido de alumínio que ativam a ação catalítica do ferro. Assim, observe como essas substâncias aparecem na equação a seguir e como elas realmente não participam da reação, apenas aceleram o processo:

Processo de Haber-Bosch de fabricação da amônia
Isso nos mostra que o uso de catalisadores é muito importante principalmente para as indústrias, pois viabiliza processos que demorariam muito para serem realizados. É importante entender que as substâncias catalisadoras não aumentam a quantidade de produto da reação, apenas aceleram o processo.
Mas surge a pergunta: como os catalisadores aumentam a velocidade das reações?
Eles conseguem isso porque trocam o mecanismo pelo qual a reação se processa, ou seja, eles formam um “caminho” alternativo para que a reação ocorra com uma energia de ativação menor.
Digamos, por exemplo, que a seguinte reação genérica ocorra sem o uso de catalisadores:
A2 + B2 → 2 AB
Assim como ocorre com toda reação, essa também será realizada somente se os reagentes atingirem a energia de ativação, que é a energia mínima para que se forme o complexo ativado, uma estrutura intermediária e instável entre os reagentes e os produtos.
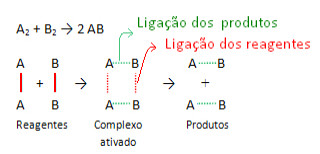
Formação de complexo ativado em reação química genérica
A seguir há um gráfico que ilustra esse processo. Veja como a energia de ativação tem um valor elevado na formação do complexo ativado e como ela funciona como uma espécie de obstáculo para que a reação ocorra:
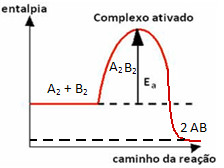
Gráfico com energia de ativação em reação sem catalisador
Agora se usarmos um catalisador “C” para a realização dessa reação genérica, ele combinar-se-á com um dos reagentes, formando o composto intermediário que, por sua vez, transformar-se-á no produto esperado, e o catalisador será regenerado. Isso acontece, por exemplo, da seguinte forma:
A2 + B2 → 2 AB
1ª etapa: A2 + C → A2C (composto intermediário)
2ª etapa: A2C + B2 → 2 AB + C
(produto) (catalisador)
Quando a reação se processa por esse caminho, a energia de ativação é menor, como mostra o gráfico a seguir:
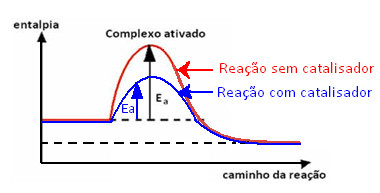
Gráfico de reação com catalisador
Quanto menor é a energia de ativação, maior é a velocidade da reação e vice-versa. É assim que os catalisadores atuam, eles conseguem aumentar a velocidade das reações porque permitem que elas ocorram com uma menor energia de ativação.
É importante lembrar também que o catalisador não altera o valor do ?H (variação de entalpia) e que, se a reação for reversível, ele diminuirá a energia de ativação tanto da reação direta quanto da inversa, provocando o aceleramento das reações em ambos os sentidos.
Aproveite para conferir a nossa videoaula relacionada ao assunto: