Geometria piramidal
A geometria piramidal é uma forma particular de disposição de átomos em uma molécula tetratômica, a qual apresenta elétrons não ligantes no átomo central.
Por Diogo Lopes Dias

PUBLICIDADE
Geometria piramidal é um caso particular de geometria molecular – os outros casos são a linear, tetraédrica, angular etc. –, ou seja, uma das formas como os átomos de uma molécula estão dispostos no espaço.
Diferentemente das outras formas de geometria molecular, na geometria piramidal, os átomos de uma molécula tetratômica organizam-se de forma que três deles fiquem ligados a um átomo central, formando uma pirâmide trigonal, como na representação abaixo:
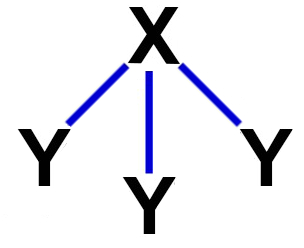
Representação geral de uma geometria piramidal
Para que uma molécula apresente a geometria piramidal, é fundamental que ela tenha as seguintes características:
-
Possuir apenas quatro átomos;
-
Três dos átomos da molécula devem estar ligados a um átomo central;
-
O átomo central deve apresentar uma nuvem (um par de elétrons) não ligante.
A seguir, conheça alguns exemplos de moléculas que se encaixam nos critérios propostos acima e, por isso, apresentam a geometria piramidal:
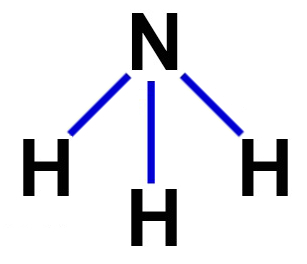
1º Exemplo: amônia (NH3)
A amônia apresenta geometria piramidal porque possui os seguintes critérios:
-
Sua molécula é tetratômica;
-
O nitrogênio é o átomo central por realizar o maior número de ligações (três, pois pertence à família VA);
-
O átomo central (nitrogênio) apresenta cinco elétrons na camada de valência (por pertencer à família VA da tabela periódica);
-
Três elétrons do átomo central são utilizados nas ligações sigma com os átomos de hidrogênio;
-
Sobra um par de elétrons no átomo central.
Não pare agora... Tem mais depois da publicidade ;)
2º Exemplo: tricloreto de fósforo (PCl3)
O tricloreto de fósforo apresenta geometria piramidal porque possui os seguintes critérios:
-
Sua molécula é tetratômica;
-
O fósforo será o átomo central por realizar o maior número de ligações (três, pois pertence à família VA);
-
O átomo central (fósforo) apresenta cinco elétrons na camada de valência (por pertencer à família VA da tabela periódica);
-
Três elétrons do átomo central são utilizados nas ligações sigma com os átomos de cloro;
-
Sobra um par de elétrons no átomo central.
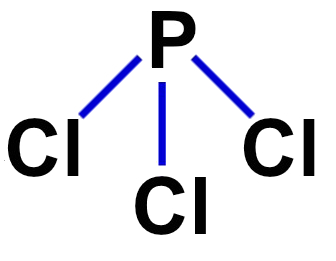
Fórmula estrutural do tricloreto de fósforo.
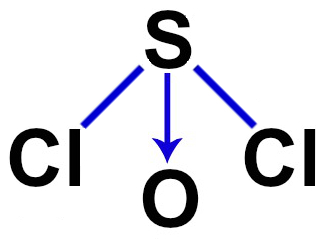
3º Exemplo: cloreto de tionila (SOCl2)
O cloreto de tionila apresenta geometria piramidal porque possui os seguintes critérios:
-
Sua molécula é tetratômica;
-
O enxofre será o átomo central, por fazer mais ligações e por ser menos eletronegativo;
-
O átomo central (enxofre) apresenta seis elétrons na camada de valência (por pertencer à família VIA da tabela periódica);
-
Dois elétrons do átomo central são utilizados nas ligações sigma com os átomos de cloro;
-
Outros dois elétrons do átomo central são utilizados com a ligação coordenada dativa com o oxigênio;
-
Sobra um par de elétrons no átomo central.