Halogênios
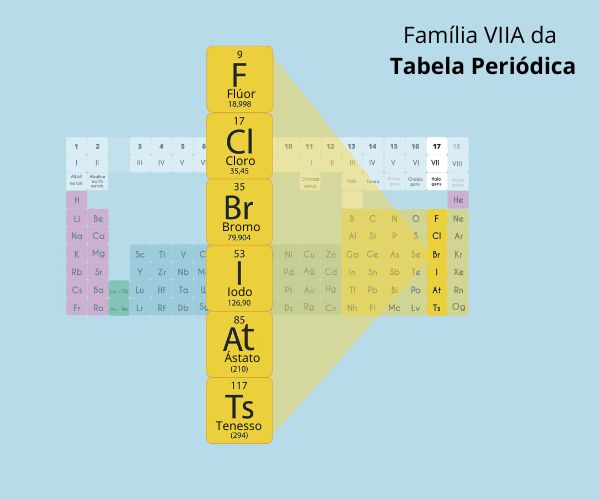
Os halogênios são os elementos que formam o grupo 17 (família VIIA) da Tabela Periódica. Esse grupo é composto pelos elementos: flúor, cloro, iodo, bromo, ástato e tenesso.
Por Jhonilson Pereira Gonçalves
PUBLICIDADE
Os halogênios formam o grupo 17 da Tabela Periódica (família VIIA), cujos elementos químicos são o flúor (F), cloro (Cl), bromo (Br), iodo (I), ástato (At) e, mais recentemente, o tenesso (Ts). Esses elementos são conhecidos por suas características marcantes, como alta reatividade e eletronegatividade, além de formar ânions quando ionizados. Nesse contexto, a capacidade de formar compostos estáveis e sua influência na química orgânica e inorgânica os tornam componentes essenciais em muitos processos químicos e tecnológicos.
Leia também: Família do nitrogênio — elementos do grupo 15 da Tabela Periódica
Resumo sobre os halogênios
- O grupo dos halogênios inclui flúor, cloro, bromo, iodo, ástato e tenesso.
- Propriedades comuns: alta reatividade, eletronegatividade e tendência a formar ânions.
- Flúor e cloro são gases, bromo é líquido e iodo é sólido em temperatura ambiente.
- Os halogênios são utilizados na desinfecção de água (cloração), prevenção de cárie dentária (fluoretação), produção de plásticos, compostos químicos e retardantes de chama.
- O iodo é essencial para hormônios da tireoide, usado como antisséptico e em radioterapia controlada.
- A capacidade de formarem compostos estáveis e influenciarem reações químicas é fundamental em várias indústrias e campos científicos.
- Desempenham papéis fundamentais na síntese de compostos orgânicos e na química medicinal.
O que são halogênios?
Os halogênios são elementos químicos pertencentes ao grupo 17 da Tabela Periódica, também conhecido como o grupo dos halogênios, o qual, atualmente, é composto por seis elementos:
- flúor (F);
- cloro (Cl);
- bromo (Br);
- iodo (I);
- ástato (At);
- tenesso (Ts).
Eles compartilham algumas propriedades químicas, como alta reatividade e tendência a formarem compostos iônicos com metais. Além disso, os halogênios são altamente reativos devido à sua configuração eletrônica, tendo sete elétrons na camada de valência. Sendo assim, eles tendem a ganhar um elétron para atingir a configuração estável de oito elétrons na camada externa, adquirindo uma carga negativa para formar ânions.
O que significa ser halogênio?
Também vale destacar que o termo halogênio foi introduzido na química por Berzelius, no século XIX, para descrever esse grupo de elementos químicos. Nesse sentido, a palavra halogênio deriva do grego, halo — “sal” — e gênio — “gerador” ou “produtor”.
Dessa forma, o nome se refere à capacidade desses elementos de formarem compostos iônicos conhecidos como sais quando reagem com metais. Sendo assim, a tendência dos halogênios a formarem sais quando combinados com metais levou à associação com a palavra grega halo.
Veja também: O que são elementos calcogênios?
Quais são os elementos halogênios?
Os halogênios conhecidos até então são estes seis elementos:
- flúor (F);
- cloro (Cl);
- bromo (Br);
- iodo (I);
- ástato (At);
- tenesso (Ts).
Esses elementos compartilham propriedades químicas semelhantes devido à sua configuração eletrônica e posição na Tabela Periódica.
Quais são as características dos halogênios?
Para que você possa compreender melhor as características desse grupo, vamos primeiramente explorar as características de cada um de seus elementos.
→ Características do flúor

Tem como principais características:
- É o elemento mais eletronegativo da Tabela Periódica, o que significa que tem uma forte atração pelos elétrons. Isso o torna altamente reativo e capaz de formar compostos facilmente.
- É o único dos halogênios que se apresenta na forma gasosa em temperatura ambiente, tendo um aspecto pálido e amarelado.
- Em grandes quantidades, o flúor pode ser tóxico para os seres humanos. No entanto, em doses controladas, é seguro e benéfico para a saúde dental.
Essas características fazem do flúor um elemento de grande importância em diversas áreas, especialmente na odontologia e na indústria química.
→ Características do cloro

O cloro tem como principais características:
- É um gás amarelo esverdeado e é o segundo elemento mais leve do grupo dos halogênios.
- Assim como os outros halogênios, o cloro é altamente reativo. Sendo assim, é capaz de formar compostos com uma variedade de elementos, sendo especialmente reconhecido por sua forte tendência a reagir com metais.
- Em altas concentrações, pode ser tóxico e irritante para os olhos, pele e sistema respiratório.
Um fato curioso sobre o cloro é que, infelizmente, ele foi usado como arma química em guerras no passado. Seu uso para esse fim é proibido pela Convenção de Armas Químicas. Para saber mais sobre esse elemento, clique aqui.
→ Características do bromo

Tem como principais características:
- Em temperatura ambiente, o bromo é um líquido volátil, denso e de cor vermelha acastanhada, além de ser o único halogênio que se apresenta no estado líquido em condições normais de temperatura e pressão.
- Assim como outros halogênios, o bromo é altamente reativo, pois forma compostos com diversos elementos, embora seja menos reativo do que o flúor e o cloro.
- É encontrado na natureza, principalmente dissolvido na água do mar e em algumas fontes minerais, além de ser obtido como subproduto de certos processos industriais.
- É tóxico em sua forma pura e pode ser irritante para a pele e membranas mucosas. Devido à sua natureza corrosiva, é manuseado com cuidado em laboratórios e indústrias.
- Além de ser um líquido em temperatura ambiente, o bromo tem a capacidade de sublimar facilmente, passando do estado sólido diretamente para o gasoso.
Essas características o tornam valioso em certos setores industriais, especialmente na produção de retardantes de chama, ajudando a proteger contra incêndios.
→ Características do iodo
- Em temperatura ambiente, o iodo é um sólido negro brilhante com um leve brilho metálico. Entretanto, quando aquecido, transforma-se diretamente de sólido para vapor, sem passar pelo estado líquido — um processo chamado de sublimação.
- É menos reativo do que o flúor, o cloro e o bromo. No entanto, ainda é capaz de formar compostos com outros elementos, especialmente em reações orgânicas.
- Pode ser encontrado em pequenas quantidades em alimentos como frutos do mar, algas e em alguns tipos de sal que são iodados para prevenir deficiências de iodo na população.
- Em grandes quantidades, o iodo pode ser tóxico. No entanto, em doses adequadas, é essencial para a saúde humana. O iodo tem como símbolo o I; seu número atômico é 53.
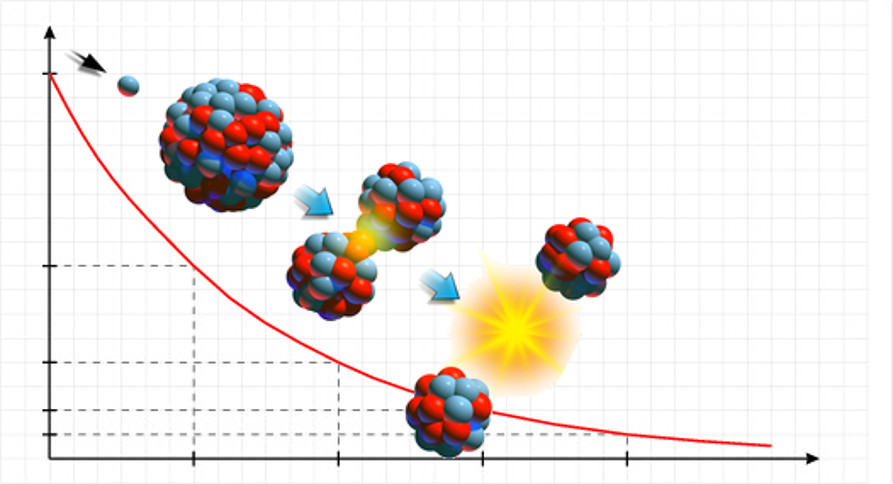
→ Características do ástato
Por ser altamente instável e ter meia-vida muito curta para muitos de seus isótopos, suas características são difíceis de estudar em detalhes. Entretanto, aqui estão algumas das características gerais conhecidas sobre o ástato:
- Em condições normais de temperatura e pressão, é esperado que o ástato seja um sólido em temperatura ambiente.
- Todos os isótopos do ástato são radioativos, o que significa que emitem radiação durante a sua desintegração nuclear, logo, é difícil estudá-lo em profundidade, o que limita suas aplicações práticas.
- A maioria dos seus isótopos tem meia-vida extremamente curta, o que significa que eles se decompõem rapidamente em outros elementos.
- O ástato é produzido artificialmente em laboratórios por meio de reações nucleares. Geralmente, é obtido bombardeando bismuto ou bismuto-209 com partículas alfa.
- É extremamente raro na natureza e normalmente é encontrado em quantidades ínfimas como resultado da desintegração radioativa de minerais de urânio e tório.
Sendo assim, devido à sua natureza altamente instável e radioativa, o ástato é um elemento desafiador de estudar e suas aplicações práticas são bastante limitadas. Dessa forma, grande parte do que se sabe sobre ele vem de estudos teóricos e experimentos limitados em laboratório. O símbolo do ástato é At e seu número atômico é 85.
→ Características do tenesso
O tenesso (Ts) é um elemento altamente radioativo e superpesado com número atômico 117 na Tabela Periódica. Ao contrário dos outros elementos desse grupo, a maior parte do que se sabe sobre o tenesso é baseada em predições teóricas e em dados experimentais limitados devido à sua vida extremamente curta e à dificuldade de sua produção.
Entretanto, podemos descrever algumas das características gerais do tenesso:
- Natureza radioativa: sendo um elemento superpesado, o tenesso é altamente instável e tem uma vida útil extremamente curta, da ordem de milissegundos ou menos, antes de decair em elementos mais leves por meio de emissões de partículas radioativas.
- Síntese artificial: foi produzido pela primeira vez por meio de reações nucleares, envolvendo a colisão de átomos de cálcio (Ca-48) com átomos de berquélio (Bk-249), em laboratórios especializados.
- Pertence ao grupo dos elementos transactinídeos: uma categoria de elementos extremamente pesados que estão além do elemento de número atômico 103 (laurêncio) na Tabela Periódica.
Por fim, devido à sua instabilidade e curta vida útil, informações detalhadas sobre suas propriedades químicas e físicas ainda são limitadas. Vale ressaltar que a síntese e o estudo de elementos superpesados, como o tenesso, contribuem para a compreensão da estrutura dos átomos e da estabilidade dos elementos, além de expandir o conhecimento sobre a Física nuclear e a Tabela Periódica.
Propriedades gerais dos halogênios
Como vimos até aqui, os elementos desse grupo são extremamente reativos devido a sua estrutura atômica apresentar sete elétrons acentuando sua eletronegatividade. Diante disso, podemos pontuar algumas de suas propriedades gerais.
- Eletronegatividade: os halogênios são altamente eletronegativos, pois têm sete elétrons na camada de valência. Sendo assim, eles tendem a ganhar um elétron para atingir a configuração de gás nobre de oito elétrons na camada externa, formando ânions negativos.
- Reatividade: são altamente reativos devido à sua configuração eletrônica (altamente eletronegativos), por isso reagem facilmente com outros elementos para formar compostos, especialmente com metais alcalinos e alcalinos terrosos, na formação de sais.
- Solubilidade: são solúveis em solventes não polares, como éter e clorofórmio, mas são pouco solúveis em água.
- Toxicidade: em sua forma pura ou em concentrações elevadas, alguns halogênios podem ser tóxicos para os seres humanos e outros organismos.
Essas propriedades gerais fazem dos halogênios um grupo importante, com amplas aplicações em várias indústrias e campos científicos. Nesse contexto, veremos alguns exemplos de suas aplicações no tópico a seguir.
Saiba mais: Como é feita a classificação dos elementos químicos na Tabela Periódica?
Para que servem os halogênios?
Como visto, quase todos os halogênios apresentam aplicações práticas e já são bem conhecidos pela população no geral. Sendo assim, vamos destacar as principais aplicações dos elementos desse grupo.
- Desinfecção e purificação: o cloro é um exemplo significativo, pois é utilizado na purificação de água potável e na desinfecção de piscinas, eliminando microrganismos e tornando a água segura para consumo humano.

- Na indústria química: também vale destacar que o cloro é amplamente utilizado na indústria para a produção de uma variedade de produtos químicos, incluindo plásticos, produtos de limpeza, solventes, PVC (policloreto de vinila), entre outros.

- Na odontologia: o flúor é essencial para a prevenção da cárie dentária, por isso a fluoretação da água e o uso de compostos de flúor em cremes dentais contribuem para a saúde bucal, fortalecendo o esmalte dos dentes e tornando-os mais resistentes à deterioração causada por ácidos produzidos por bactérias.
- Retardantes de chama: o bromo é usado como retardante de chama em produtos, especialmente em plásticos e têxteis. Ajuda a retardar a propagação do fogo, reduzindo os riscos de incêndio.

- Na medicina: o iodo é utilizado como antisséptico, e em radioterapia é usado para tratamento de alguns tipos de câncer devido à radioatividade controlada. Além disso, é essencial para a produção de hormônios da tireoide. Vale destacar que a deficiência de iodo pode levar a distúrbios da tireoide, como bócio (aumento anormal da glândula tireoide), e pode causar problemas de saúde, especialmente em partes do corpo nas quais o iodo na dieta é insuficiente.

Além desses exemplos, os halogênios são usados em várias reações químicas na síntese de compostos orgânicos, desempenhando papéis essenciais em laboratórios e indústrias farmacêuticas. Por fim, quanto ao ástato, algumas pesquisas sugerem seu potencial em terapias contra o câncer, devido à sua capacidade de liberar radiação em células cancerosas específicas. Já sobre o tenesso, por outro lado, a literatura ainda está limitada quanto às suas aplicações.
Exercícios resolvidos sobre halogênios
1. A Tabela Periódica é organizada em períodos e grupos (famílias), cujos elementos são dispostos de acordo com seus números atômicos. Nesse contexto, sabe-se que elementos de um mesmo grupo possuem propriedades semelhantes, como eletronegatividade e afinidade eletrônica. Diante disso, no grupo dos halogênios, o elemento químico mais eletronegativo é:
a) flúor
b) cloro
c) iodo
d) bromo
e) ástato
Gabarito: A. A eletronegatividade é uma propriedade periódica que aumenta da esquerda para a direita e de baixo para cima. Portanto, o flúor é o elemento mais eletronegativo não apenas do seu grupo como também entre todos os elementos da Tabela Periódica.
2. Os halogênios são todos os elementos químicos que compõem o grupo 17 (família VIIA) da Tabela Periódica. Têm como principal característica sete elétrons em suas camadas de valência, além de serem extremamente reativos. Não obstante, o estado físico em que são encontrados é intrínseco de cada elemento, sendo assim, assinale qual entre eles é encontrado no estado líquido em temperatura ambiente:
a) cloro
b) bromo
c) iodo
d) flúor
e) ástato
Gabarito: B. O bromo é o único halogênio que se apresenta no estado líquido em condições normais de temperatura e pressão.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Grupo 17: Os halogênios. In: Princípios de Química: Questionando a vida moderna e o meio ambiente. 7. ed. [s.l.] Bookman, 2018. p. 693–697.
HORROCKS, A. R.; PRICE, D. Advances in fire retardant materials. [s.l: s.n.].
KHAIKINA, E. G. Inorganic Chemistry. Chemistry of halogens: a textbook. [s.l: s.n.].
KIRK, K. L. Biochemistry of the Elemental Halogens and Inorganic Halides. [s.l: s.n.].
L. BROWN, T. et al. Grupo 7A: Os halogênios. In: Química: A Ciência Central. 13. ed. São Paulo: Pearson Education do Brasil., 2016. p. 326–327.
NAGY, G.; NAGY, L. Halogens. In: Handbook of Water Analysis: Third Edition. [s.l: s.n.]. p. 189–231.
PUCCIO, J. A. Halogens. In: Hamilton and Hardy’s Industrial Toxicology: Sixth Edition. [s.l: s.n.]. p. 341–356.
TOURET, J. The role of halogens in terrestrial and extraterrestrial geochemical processes. Surface, crust and mantle. International Geology Review, v. 61, n. 12, p. 1549–1551, 2019