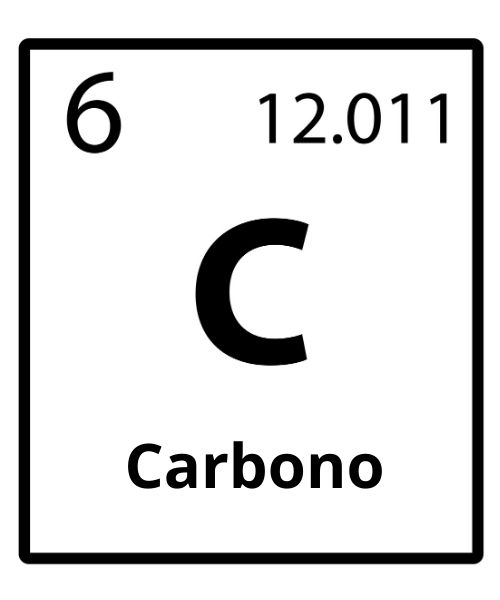
Carbono (C)
Descoberto na Pré-História, o carbono é um elemento tetravalente da família 4A, compondo inúmeras substâncias diferentes devido a suas propriedades atômicas.
Por Laysa Bernardes Marques de Araújo
PUBLICIDADE
O carbono foi descoberto na Pré-História, mas designado de tal forma apenas em 1789, por Lavoisier, com suas propriedades só vindo a ser estudadas no século XIX, por August Kekulé e Archibald Scott Couper. Trata-se de um não metal, da família 4A, tetravalente e que possui afinidade com muitos outros elementos.
O carbono está entre os cinco átomos mais abundantes do mundo, podendo ser encontrado em diversos tipos de moléculas formadoras de materiais do nosso cotidiano, como o plástico, e em forma de minerais, como o diamante. O diamante é um dos alótropos naturais do carbono, e outro é a grafita. A alotropia é a formação de diferentes compostos com base no mesmo átomo.
O carbono é um elemento abundante na natureza e muito presente na manutenção da vida, mas o seu desequilíbrio gera problemas. Nesse sentido, o dióxido de carbono liberado em processos naturais e industriais tornou-se foco de preocupação, pois altas concentrações de CO2 na atmosfera são prejudiciais ao meio ambiente, para isso se criou o crédito de carbono, que visa a reduzir esse tipo de impacto ambiental.
Leia também: Hidrogênio — o elemento químico mais abundante do Universo
Resumo sobre o carbono
- Descoberto na Pré-História, o carbono foi objeto de estudo de dois cientistas do século XIX: Friedrich August Kekulé e Archibald Scott Couper. A primeira tese a ser aceita sobre as propriedades do carbono é de Kekulé, e ela fala sobre a tetravalência, a afinidade com outros elementos e o comportamento molecular do átomo.
- O carbono é o quarto elemento mais abundante do mundo, presente em toda espécie viva e em quase toda matéria orgânica. Assume combinações moleculares como dióxido de carbono (CO2) e hidrocarbonetos, além dos compostos em mineral, como grafita e diamante.
- O carbono é um não metal da família 4A, segundo período, com seis prótons, seis elétrons e três isótopos naturais de massa 12, 13 e 14. É um elemento tetravalente e com raio atômico pequeno; tem afinidade com muitos elementos, possibilitando a formação de múltiplas moléculas.
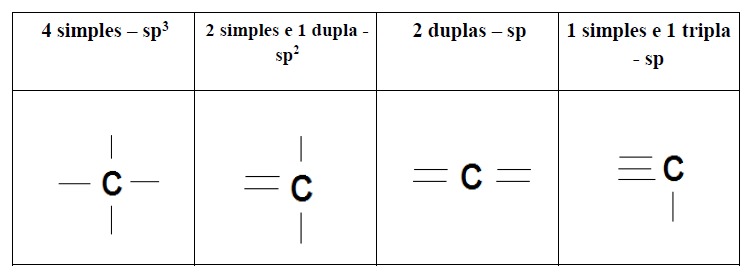
- O carbono, sendo tetravalente, pode realizar quatro ligações, com quatro outros átomos, ou ligações duplas e triplas, até que se complete a valência. Essas ligações podem ser tipo sigma ou pi.
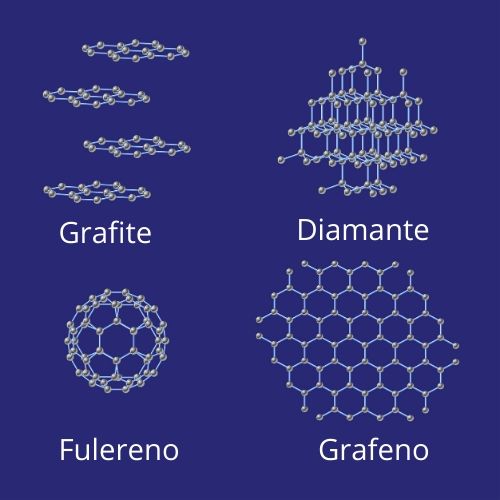
- O carbono possui quatro alótropos, sendo dois de ocorrência natural, grafita e diamante, e dois sintéticos, grafeno e fulerenos. A cada década, surgem novas descobertas de organização estrutural do carbono.
- Devido à abundância e à diversidade de compostos moleculares associados ao carbono, teremos infinitas aplicações. As mais comuns são: os hidrocarbonetos, que dão origem aos combustíveis, os carboidratos presentes nos alimentos, e os polietilenos, usados como matéria-prima para materiais de plástico. Temos também o isotopo carbono 14, usado em datação radiométrica.
- O dióxido de carbono é o composto expelido em diversos processos naturais e industriais, e apenas os vegetais absorvem o CO2, para realização da fotossintetize. Essa troca desigual gera um desequilíbrio no aquecimento global. Considerando isso, criou-se o crédito de carbono, que visa a reduzir os impactos ambientais da liberação de CO2 na atmosfera.
- A Universidade do Texas desenvolve “tatuagens de grafeno”, que prometem fazer a sondagem do corpo.
Descoberta do carbono
O carbono foi descoberto na Pré-História, aproximadamente, em 3750 a. C. Na época sabia-se do composto em forma de brasa ou fuligem. Foi designado como carbono, nome que provém do latim carbo, que significa carvão, em 1789, por Antoine Laurent Lavoisier, mas apenas no século XIX que suas propriedades físico-químicas, suas interações moleculares e seu comportamento atômico começaram a ser estudados por Friedrich August Kekulé e Archibald Scott Couper.
Em 1857, August Kekulé criou a teoria da tetracovalência do carbono, a qual fala sobre a possibilidade do composto realizar múltiplas ligações. Em 1865, inspirado por um sonho, Kekulé propôs como seria uma estrutura molecular hexagonal de carbonos, que hoje conhecemos como benzeno.
Archibald Couper, em 1858, publicou sua “nova teoria de química”, que, em suma, trata da tetravalência do carbono. De acordo com Couper, os átomos de carbono poderiam unir-se, formando moléculas carbônicas conforme a valência do átomo. Perceba que se trata do mesmo conceito proposto por Kekulé, no entanto, ambas as teses são desvinculadas.
Couper teve um desentendimento com o educador Charles Adolphe Wurtz, da Escola de Medicina de Paris, instituição onde Couper desenvolvia suas pesquisas. Nesse conflito, Couper foi desacreditado e posteriormente expulso do laboratório, fazendo com que sua tese perdesse a notoriedade para a de Kekulé.
Cientistas soviéticos descobriram, em 1917, uma nova forma alotrópica do carbono, chamada carbino, como uma promissora aplicação comercial e tecnológica devido à resistência de sua estrutura. Além dos alótropos, temos arranjos moleculares de carbonos com outros átomos. Hoje se tem catalogados mais de três milhões de espécies de compostos com carbono em sua estrutura.
Um famoso alótropo do carbono é o diamante, cuja maior jazida está na Rússia e foi descoberta em 2012. Outra espécie alotrópica do carbono é o grafite, as primeiras minas de grafite foram encontradas na Alemanha, em 1400.
Principais características/propriedades do carbono
O carbono é um não metal do grupo 14 ou família 4A, segundo período. Possui seis elétrons, seis prótons e três isotopos naturais de massa 12, 13 e 14, sendo o último radioativo. Apresenta-se em estado sólido para condições normais de temperatura e pressão. Sua distribuição eletrônica é 1s2 2s2 2p2.
O carbono possui raio atômico pequeno e afinidade com muitos outros elementos pequenos, além de ser um composto tetravalente, ou seja, pode estabelecer quatro ligações com outros átomos. Essas características possibilitam a formação de uma enorme diversidade de moléculas, como dióxido de carbono, hidrocarbonetos, haletos orgânicos, entre outras.
Ligações do carbono
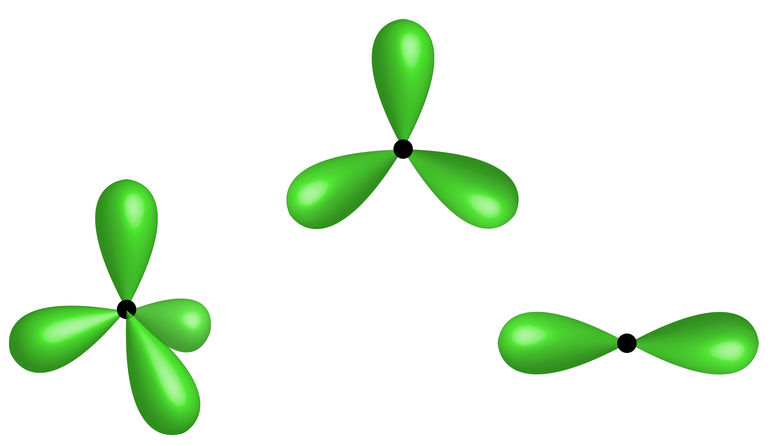
O carbono pode realizar quatro ligações com átomos diferentes ou realizar dupla e tripla ligação com o mesmo átomo, isso se deve às diferentes hibridizações que o átomo assume, e a interação entre os orbitais ligantes define se a ligação será forte ou fraca. Teremos, portanto, dois tipos de ligação sigma (σ) ou pi (π). A ligação do tipo sigma é mais forte e será a primeira a ser realizada; a ligação pi é mais fraca, também conhecida como insaturação de uma cadeia carbônica.
Veja, a seguir, a tabela com os tipos de ligações possíveis e a hibridização do carbono em cada caso:
Onde o carbono é encontrado?
O carbono é o quarto elemento mais abundante do Universo, está presente em toda espécie viva, e em quase toda matéria orgânica, além de minerais e combinações moleculares. Possui diversas combinações estruturais ou alótropos, com diferentes propriedades físico-químicas, tais como grafite, diamante, fulereno e grafeno.
Moléculas de carbono estão presentes nos combustíveis que usamos em nossos veículos, nos vasilhames de plástico, nos alimentos com carboidratos, glicose, óleos e proteínas etc.
Veja também: Propriedades dos compostos orgânicos – como eles se diferenciam?
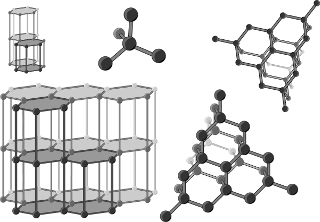
Alótropos do carbono
O carbono é um elemento capaz de ligar-se e formar moléculas de diferentes estruturas e propriedades físico-químicas, esses diferentes compostos são chamados de alótropos do carbono. Existem muitas espécies diferentes de alótropos de carbono, e, a cada década, descobre-se mais delas, além de suas possíveis aplicações. Veja, a seguir, alguns deles:
→ Carbono amorfo: não possui estrutura cristalina definida e é composto por hibridização do tipo sp2 e sp3. Estudos mostram a possibilidade da utilização dessa substância na fabricação de baterias e eletrodos, devido as suas propriedades catalisadoras e absorventes.
→ Diamante: é o alótropo de ocorrência natural, composto de elevada dureza, com átomos em hibridização do tipo sp3, o que faz com que não haja elétrons livres na sua estrutura e que, portanto, não seja um bom condutor. Tem densidade de 3,51 g/cm3 e ponto de fusão a 3550 °C. Nele cada átomo liga-se tetraedricamente a quatro outros átomos de carbono. Trata-se de uma forma de cristalização que acontece quando o elemento é submetido à alta pressão e temperatura. Possui alto valor agregado e é comercializado como pedra preciosa.
→ Grafita: é um mineral com camadas de carbono que se ligam formando arranjos planares em formato de hexágonos. Seus átomos possuem hibridização do tipo sp2, sendo, portanto, um bom condutor elétrico. É usado industrialmente na produção de lâmpadas, peças elétricas e materiais refratários. Possui baixa dureza e alto ponto de fusão.
→ Fulereno: é uma substância sintética obtida pela vaporização da grafita em atmosfera de gás hélio. Possui densidade de 1,65 g/cm3, menor do que dos demais alótropos do carbono. Sua estrutura é composta por 60 átomos de carbono ligados em forma de hexágono, assim como a grafita, porém organizados esfericamente, gerando-lhe aspecto semelhante a uma bola de futebol. É utilizado medicinalmente como antioxidante, antiviral e contraste para processos de diagnóstico.
→ Grafeno: é considerado o material mais fino do mundo, pois sua estrutura é da espessura de um átomo de carbono e sua organização é uma folha planar. Constituído de ligações do tipo sp2, é um ótimo condutor e possui alta resistência. O grafeno é extraído pela esfoliação mecânica do grafite, trata-se, portanto, de um material sintético.
Aplicações do carbono
O carbono está presente em diversos materiais de uso cotidiano, como vasilhames de plásticos e garrafas PET, isso porque o polietileno (matéria-prima do plástico) é constituído de cadeias carbônicas. O mesmo ocorre com as margarinas, os carboidratos, os combustíveis fósseis, o etanol, os óleos e graxas, cada um com sua respectiva função orgânica.
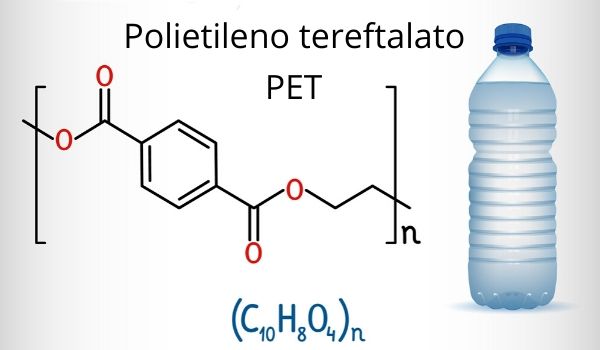
No setor tecnológico, temos os nanotubos de carbono, que são ótimos condutores elétricos, térmicos e mecânicos. Outro exemplo é o isótopo carbono 14, usado como aliado da ciência investigativa, pois, por meio de seu decaimento radioativo, estima-se a idade de um fóssil ou objeto, técnica muito utilizado na arqueologia. Devido à diversidade de moléculas possíveis com o elemento carbono, temos também infinitas aplicações.
Leia também: Função orgânica dos hidrocarbonetos
Ciclo do carbono
Visto que o carbono é um dos elementos mais abundantes do Universo e que está presente na constituição da vida terrestre, temos a participação dele também na manutenção da vida. Nos processos metabólicos, na respiração celular, na decomposição e na fermentação, há liberação do dióxido de carbono (CO2), um gás de efeito estufa.
O CO2 acumulado na atmosfera produz uma espécie de filtro que permite a energia solar entrar, mas não a permite sair, retendo seu calor na superfície da terra. Até certo ponto, isso é bom, foi esse processo que permitiu o desenvolvimento da vida terrestre. No entanto, com o surgimento das indústrias e a utilização de combustíveis fosseis, provocou-se um aumento da emissão de gás carbônico, tornando a retenção de calor prejudicial ao ecossistema. A absorção do dióxido de carbono só é feita por organismos fotossintetizantes.
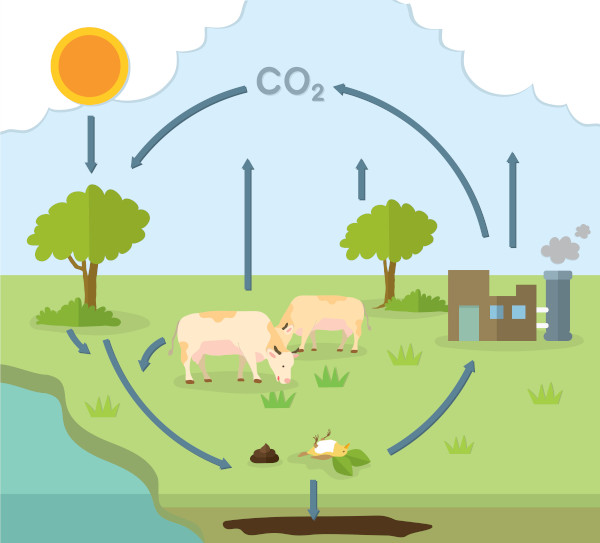
Alguns países preocupados com esse desequilíbrio criaram o crédito de carbono — um protocolo que visa a diminuir a emissão dos gases de efeito estufa, ditando que cada país tenha uma quantidade x de emissão de CO2 permitida e (quando se passa desse limite) a necessidade de realização de projetos ambientais que neutralizem ou diminuam os impactos desse excesso de emissão.
Leia também: Qual a relação entre o efeito estufa e o aquecimento global?
Curiosidades sobre o carbono
Já imaginou ter ao alcance da pele uma tela que mostre suas informações vitais? É o que propõe a Cockrell School of Engineering, da Universidade do Texas, fazendo uso do grafeno — um alótropo do carbono com propriedades únicas de condutividade, resistência, dureza, além de ter uma espessura superfina, devido a sua organização estrutural em forma de folha.
O aparato, além de verificar os sinais vitais, promete escanear o sistema nervoso, o cérebro, o coração e os músculos. A ideia é que ele se sobressaia aos equipamentos já existentes por não precisar de fios ou baterias e por ser mais eficiente, visto que está em contato direto com o corpo.
Exercícios resolvidos sobre o carbono
Questão 1 - Sobre o fenômeno da alotropia do carbono, julgue como verdadeiro ou falso.
I - Existem sete formas alotrópicas do carbono de ocorrência natural, o grafeno e o fulereno são duas delas.
II - O diamante é uma forma alotrópica do carbono, forjado nas camadas mais internas da crosta terrestre e em condições de elevada temperatura e pressão.
III - Alótropos do carbono são moléculas com mesmo número de átomos em sua estrutura principal, o que difere uma da outra é o posicionamento de heteroátomos presentes.
Assinale a alternativa correta:
a) Estão verdadeiras I e II.
b) São falsas II e III.
c) Apenas a III é verdadeira.
d) Apenas a II é falsa.
e) Apenas a II é verdadeira.
Resolução
Alternativa E. Na afirmativa I, está incorreto dizer que existem sete alótropos naturais do carbono. De ocorrência natural, existem apenas dois: grafita e diamante.
Já na sentença III, a definição de alotropia está incorreta. Alotropia é o fenômeno que ocorre quando um mesmo elemento origina substâncias diferentes devido à organização estrutural e espacial das suas moléculas.
Questão 2 - Para as moléculas metano (CH4) e eteno (C2H4), a hibridização dos carbonos é, respectivamente:
a) sp3, sp2 e sp2.
b) sp, sp2 e sp.
c) sp3, sp e sp2.
d) todos são sp3.
e) todos são sp2.
Resolução
Alternativa A. A molécula de metano possui apenas um carbono, que realiza quatro ligações do tipo sigma com hidrogênios, portanto, sp3. Na molécula de eteno, temos dois carbonos realizando dupla ligação entre si, portanto, ambos são sp2.
Questão 3 - Sobre o carbono, marque a alternativa incorreta:
a) O carbono é um elemento tetravalente e de raio atômico pequeno. Possui afinidade com outros elementos pequenos, o que o torna capaz de formar múltiplas moléculas.
b) O carbono é um dos elementos mais abundantes do mundo, está presente em toda forma de vida terrestre.
c) Os altos índices de emissão de CO2 na atmosfera são responsáveis pelo aquecimento global e o efeito estufa, que desde sempre são processos que geram impactos negativos ao ambiente.
d) O crédito de carbono é uma iniciativa que visa a diminuir os impactos da emissão de CO2 na atmosfera, estabelecendo limites de emissão e ditando a necessidade de projetos ambientais, como o reflorestamento.
e) O carbono está presente em muitos produtos do nosso cotidiano, como plástico, margarina, pão e combustíveis.
Resolução
Alternativa C. O efeito estufa nem sempre gerou impactos negativos, na verdade, ele foi um dos fatores responsáveis pelo desenvolvimento da vida terrestre. O aumento da emissão de gases do grupo GEE (Gases de Efeito Estufa) intensificou a retenção de energia solar na atmosfera terrestre, desequilibrando o sistema, o que gerou impactos negativos.