Hidrocarbonetos
Hidrocarbonetos são moléculas constituídas de carbono e hidrogênio. São classificados de acordo com a insaturação da cadeia.
Por Laysa Bernardes Marques de Araújo

PUBLICIDADE
Hidrocarbonetos são moléculas apolares, homogêneas e formadas por átomos de carbono e hidrogênio. Podem ser saturados, como no caso dos alcanos e cicloalcanos, nos quais não se tem a presença de duplas ou triplas ligações, ou podem ser insaturados, como alcenos, alcinos, ciclenos, entre outros. Também fazem parte da classe dos hidrocarbonetos os compostos aromáticos, que possuem o fenômeno da ressonância.
A maior fonte de hidrocarbonetos é o petróleo e o gás natural, mas eles podem ser encontrados também em seringueiras e óleos essenciais. Já os compostos do tipo alcino e ciclino só podem ser obtidos de forma sintética.
Leia também: O que são polímeros?
O que são hidrocarbonetos?
São moléculas constituídas apenas por carbono e hidrogênio, e os átomos são unidos por ligação covalente do tipo simples, dupla ou tripla. Formam moléculas apolares, que se unem por ligação do tipo dipolo induzido.
Esses compostos orgânicos estão muito presentes no nosso cotidiano, como nos combustíveis automotivos, nas velas, no gás de cozinha, entre outros. Vale destacar ainda que a tetravalência do carbono permite que sejam originadas cadeias de estrutura diversificada.
Características físico-químicas dos hidrocarbonetos
→ Estado físico
O estado físico dos hidrocarbonetos (em condições normais de temperatura e pressão), assim como o ponto de fusão e ebulição variam conforme a quantidade de carbonos na cadeia. Veja a regra a seguir, que se aplica a hidrocarbonetos de cadeia aberta e fechada.
• Gasosos: compostos de 1 a 4 carbonos.
• Líquidos: compostos de 5 a 17 carbonos.
• Sólidos: compostos com mais de 17 carbonos.
→ Densidade
Os hidrocarbonetos possuem densidade inferior à da água.
→ Solubilidade
São majoritariamente insolúveis em compostos polares.
→ Reatividade
A reatividade varia conforme a cadeia.
• Baixa reatividade: moléculas acíclicas (cadeia aberta) e saturadas (apenas ligações simples).
• Moderada reatividade: compostos acíclicos com instaurações (duplas ou triplas ligações).
• Alta reatividade: compostos cíclicos (cadeia fechada) com 3 a 5 carbonos na cadeia.
Nomenclatura dos hidrocarbonetos
A nomenclatura dos hidrocarbonetos segue as regras propostas pela União Internacional da Química Pura e Aplicada (Iupac). Para nomear os compostos, deve-se:
⇒ 1° passo: fazer a contagem dos carbonos da cadeia principal, que é a sequência com mais carbonos e que contém as insaturações. A contagem deve iniciar-se pela extremidade mais próxima das insaturações; se não houver insaturações, começar pelo lado mais próximo das ramificações. O prefixo da nomenclatura é determinado pela quantidades de carbonos na cadeia principal.
• 1 carbono: met-
• 2 carbonos: et-
• 3 carbonos: prop-
• 4 carbonos: but-
• 5 carbonos: pent-
• 6 carbonos: hex-
• 7 carbonos: hept-
• 8 carbonos: oct-
• 9 carbonos: non-
• 10 carbonos: dec-
Exemplos:
CH4 → Metano
CH3-CH3 → Etano
CH3-CH2-CH3 → Propano
CH3-CH2-CH2-CH3 → Butano
⇒ 2° passo: verificar se há ramificações; se houver, nomear e indicar em qual posição (em qual carbono se encontra). O nome e posição dos radicais vêm antes do prefixo do composto e, quando houver mais de um radical, deverá aparecer em ordem alfabética. A nomenclatura do radical será dada por prefixo indicando o número de carbonos + terminação “il ou ila”. Se houver duas ramificações iguais, usa-se o termo “di” antes do nome do radical.
Exemplos:
→ 2,3-dimetil-pentano
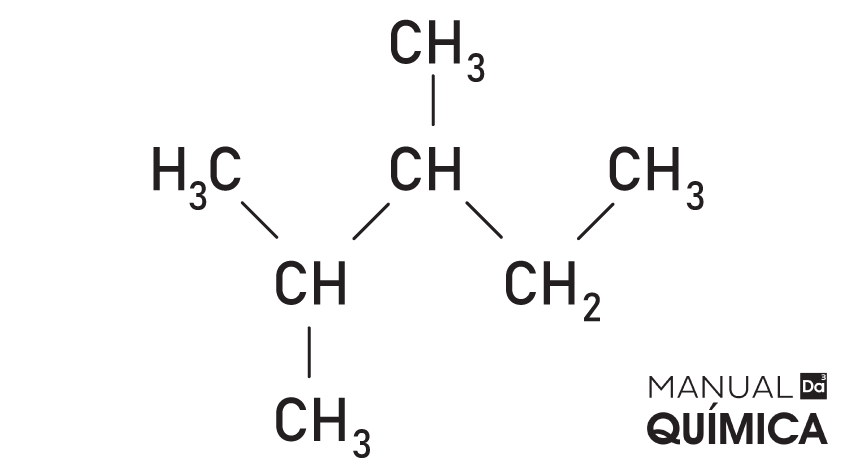
→ 3-etil-pentano
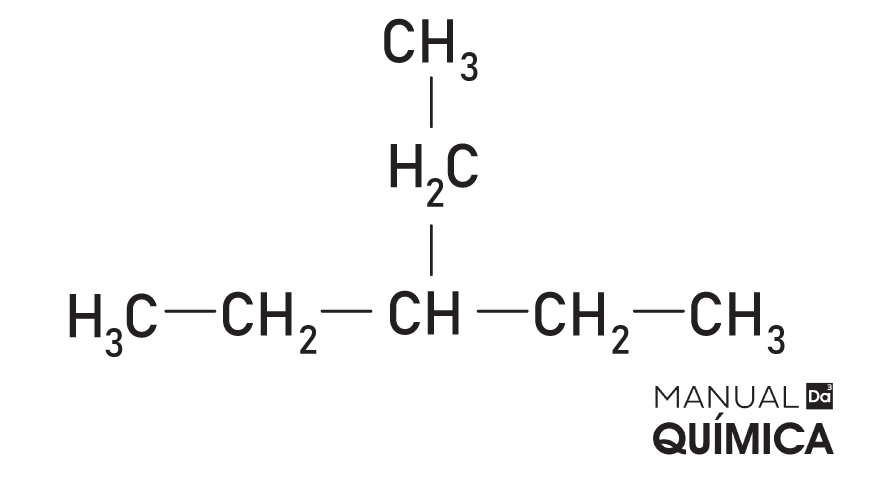
→ 2-etil-3-metil-butano
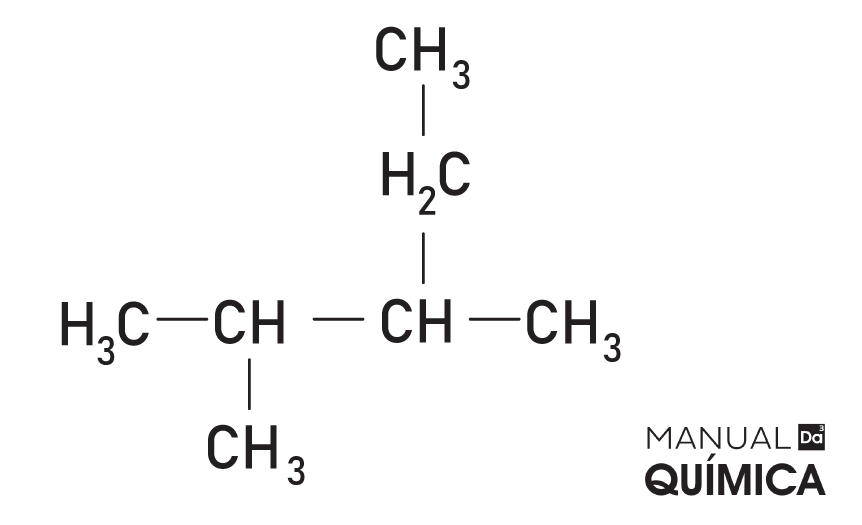
Leia também: Nomenclatura de alcanos ramificados
⇒ 3° passo: verificar se há insaturações e, se houver, localizar em que carbono se encontra a insaturação, acompanhado do sufixo do composto, que será de acordo com a saturação da cadeia.
- Saturada (sem duplas ou triplas ligações): -ano.
- Insaturadas:
• 1 dupla ligação: -eno
• 2 duas ligações: -dieno
• 1 tripla ligação: -in
Exemplos:
CH2=CH2 → Eteno
CH3-CH=CH2 → Prop-1-eno ou propeno
CH2=C=CH2-CH3 → But-1,2dieno
CH≡CH-CH3 → Prop-1-ino ou propino
Leia também: Nomenclatura de hidrocarbonetos insaturados de cadeia aberta
⇒ 4° passo: observar se a cadeia é fechada ou aberta; caso seja uma cadeia fechada, a palavra ciclo deve preceder a nomenclatura dada à cadeia principal.
Exemplos:
→ Ciclopropano
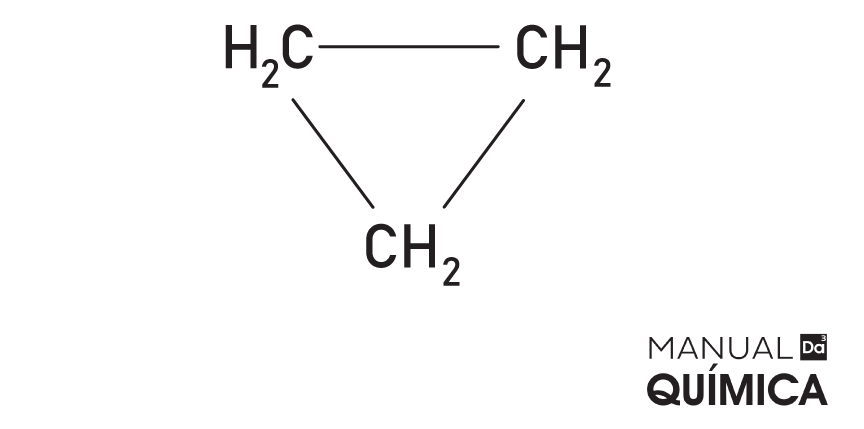
→ 2-metil-ciclobuteno
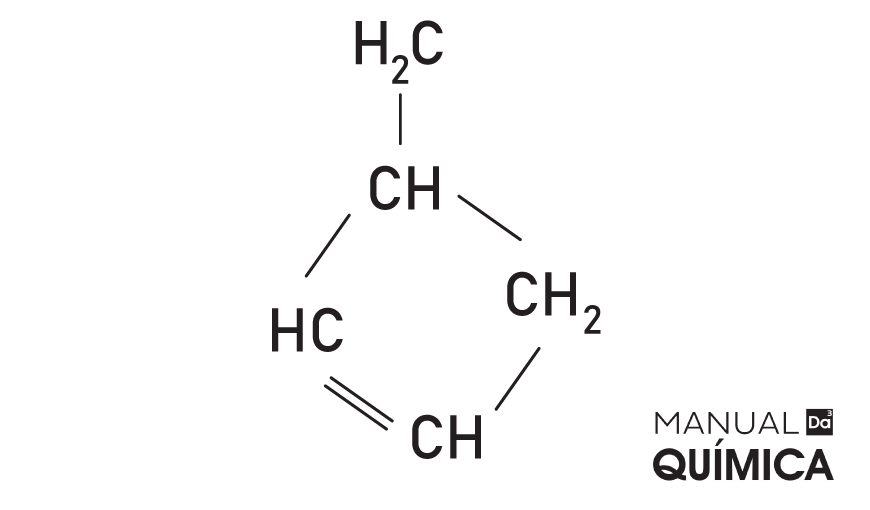
Veja também: Nomenclatura de hidrocarbonetos de cadeia fechada
Classes dos hidrocarbonetos
A classificação dos hidrocarbonetos é feita levando-se em conta a saturação, ou seja, a presença ou não de dupla(s) ou tripla(s) ligações e a ciclização da cadeia (cadeia fechada ou aberta).
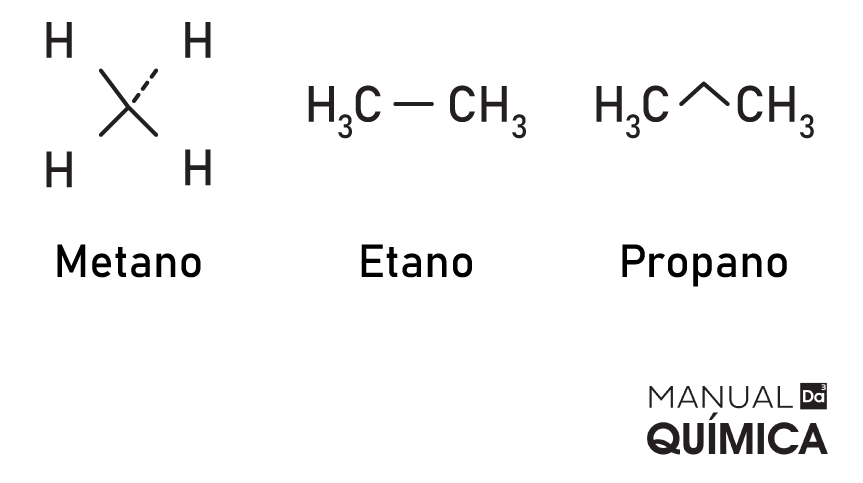
→ Alcanos ou parafinas
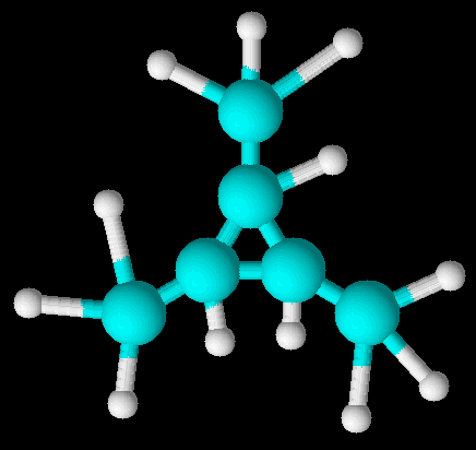
Os alcanos são as cadeias carbônicas abertas constituídas apenas por ligações simples, ou seja, estão “saturadas” com ligações do tipo sigma. Todos os carbonos desse tipo de molécula têm hibridização sp³. As principais fontes de alcanos são petróleo bruto e gás natural. A fórmula geral das moléculas de alcanos é:
CnH2n+2
Eles são também chamados de parafina em razão da sua pouca reatividade com outras moléculas. O termo “parafina” vem do latim e significa pouca afinidade.
Exemplos:
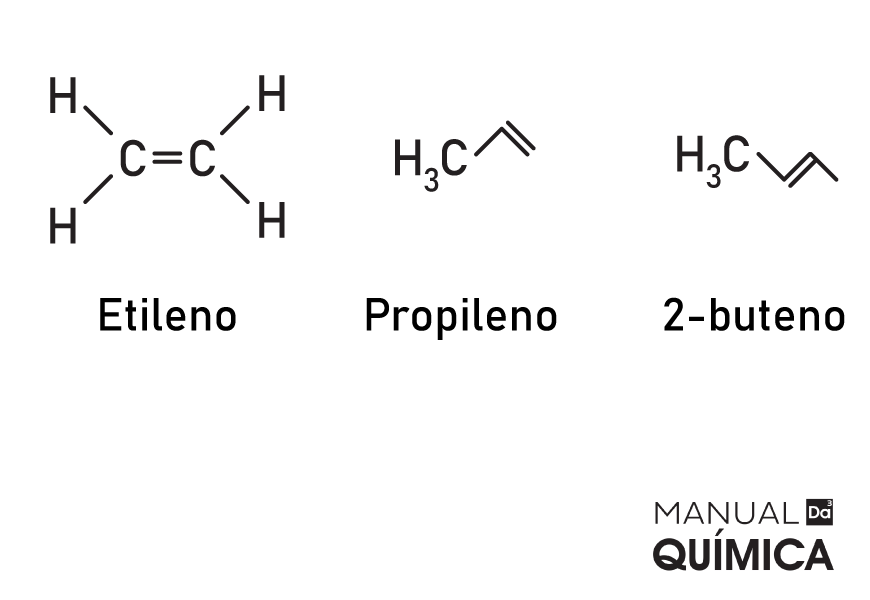
→ Alcenos ou olefinas
Os alcenos são hidrocarbonetos alifáticos (de cadeia aberta) que possuem uma dupla ligação entre carbonos (C=C). Nesse caso os carbonos que realizam a dupla possuem hibridização do tipo sp² e geometria trigonal plana. A dupla ligação é constituída de uma ligação do tipo sigma e outra do tipo pi.
A fórmula geral dos alcenos é:
CnH2n
São compostos presentes em produtos do nosso cotidiano, como material plástico, sacolas e vasilhames.
Exemplos:
-
Alcinos
São hidrocarbonetos de cadeia aberta que contêm uma ligação tripla entre carbonos (C≡C). Os carbonos que realizam a tripla ligação apresentam hibridização do tipo sp e se comportam como elementos eletronegativos em relação aos demais carbonos da cadeia. Os alcinos em função da tripla ligação são moléculas instáveis, sintetizadas em laboratório por meio do craqueamento de alcanos.
Com exceção do acetado, que é razoavelmente solúvel em água e tem odor agradável, os demais alcinos são insolúveis em água, incolores e inodoros (sem cheiro).
A fórmula geral para alcinos é:
CnH2n-2
Exemplos:
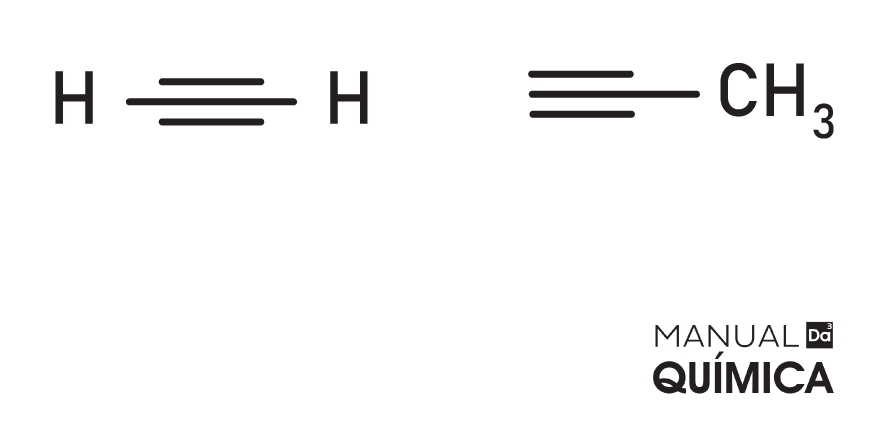
Acesse também: Classificação dos alcinos – hidrocarbonetos com tripla ligação
-
Alcadienos ou dienos
São moléculas de carbono e hidrogênio que possuem duas duplas ligações entre carbonos. Perceba que o termo “alcenos” refere-se a um hidrocarboneto com uma dupla ligação. Já “alcadienos” indica duas duplas ligações.
A fórmula geral para alcadienos é:
CnH2n-2
É a mesma fórmula geral dos alcinos, por isso pode acontecer isomeria (mesma fórmula molecular para estruturas diferentes) de função entre esses dois hidrocarbonetos. Alcadienos são compostos apolares, classificados de acordo com a posição das instaurações.
- Dienos acumulados: as insaturações ocorrem em carbonos vizinhos. Ex:
CH2=C=CH2
- Dienos isolados: as insaturações são separadas por no mínimo dois carbonos. Ex:
CH2=CH-CH2-CH=CH2.
- Dienos conjugados: as insaturações são intercaladas por um carbono com ligação simples. Ex:
CH2=CH-CH=CH2
O isopreno é o alcadieno que mais se destaca, por ser encontrado em diversos compostos naturais, como borrachas de seringueiras, carotenoides e óleos essenciais.
Hidrocarbonetos cíclicos
Os hidrocarbonetos cíclicos são classificados de acordo com a insaturação da cadeia. Como são hidrocarbonetos de cadeias fechadas, costuma-se representar a molécula em forma de polígonos, e cada um dos vértices da figura geométrica representa um carbono.
A estabilidade das cadeias carbônicas fechadas varia conforme a insaturação e tamanho da cadeia. O que explica essa questão é a teoria das tensões dos anéis, que afirma que as ligações são flexionadas para formação dos anéis. Sendo assim, anéis com três ou quatro carbonos terão uma tensão maior e, portanto, estarão mais propensos a se romper que anéis de cadeias carbônicas maiores. A principal fonte de obtenção é o petróleo e o gás natural, mas também podem ser encontrados em óleos e ceras.
O ponto de fusão dos hidrocarbonetos de cadeia fechada varia conforme a presença ou não de ramificações. Hidrocarbonetos ramificados, por terem uma menor superfície de contato entre uma molécula e outra, apresentam menor ponto de fusão.
-
Ciclanos
Os ciclanos ou cicloalcanos ou ainda cicloparafinas são hidrocarbonetos saturados e de cadeia fechada. Possuem características físico-químicas semelhante às dos alcanos e dos alcenos, pois possuem a mesma fórmula geral dos ciclanos.
CnH2n
Exemplos:
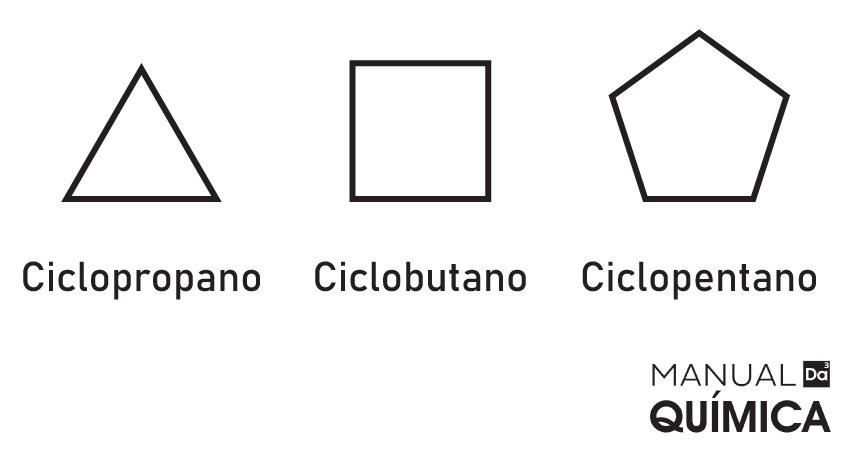
-
Ciclenos
Hidrocarbonetos de cadeia fechada que apresentam uma única ligação dupla, assim como os alcenos. Alguns ciclenos possuem odor agradável, como o pineno e alfapineno, que são da classe dos terpenos, compostos produzidos pelo metabolismo secundário dos vegetais para proteção e equilíbrio biótico.
A estabilidade de um cicleno depende da existência ou não de uma ramificação em um dos átomos de carbono que realiza a dupla ligação. Quando houver uma ramificação, a molécula será mais estável, em função da blindagem espacial causada pelo radical.
Se uma molécula da função cicleno for submetida a altas temperaturas, ela pode ter sua ligação dupla quebrada, formando assim um ciclano, ou passar por uma reação de adição, formando um álcool ou haleto orgânico.
A fórmula geral para ciclenos é:
CnH2n-2
Exemplos:
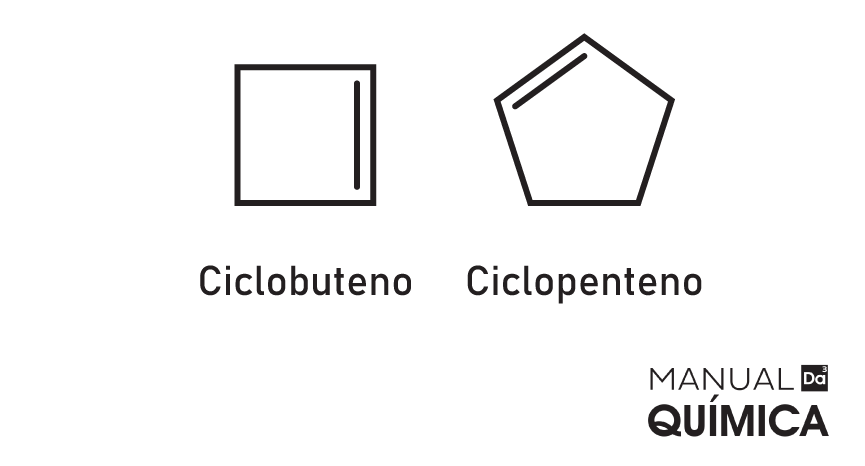
-
Ciclinos
Ciclinos, também chamados de cicloalquinos ou cicloalcinos, são hidrocarbonetos de cadeia fechada, insaturados, com a presença de uma tripla ligação na cadeia. São compostos instáveis e sintéticos, ou seja, não são encontrados livres na natureza. Devido à instabilidade da molécula, não há aplicações viáveis para esse composto.
Sua fórmula geral é:
CnH2n-4
Exemplo
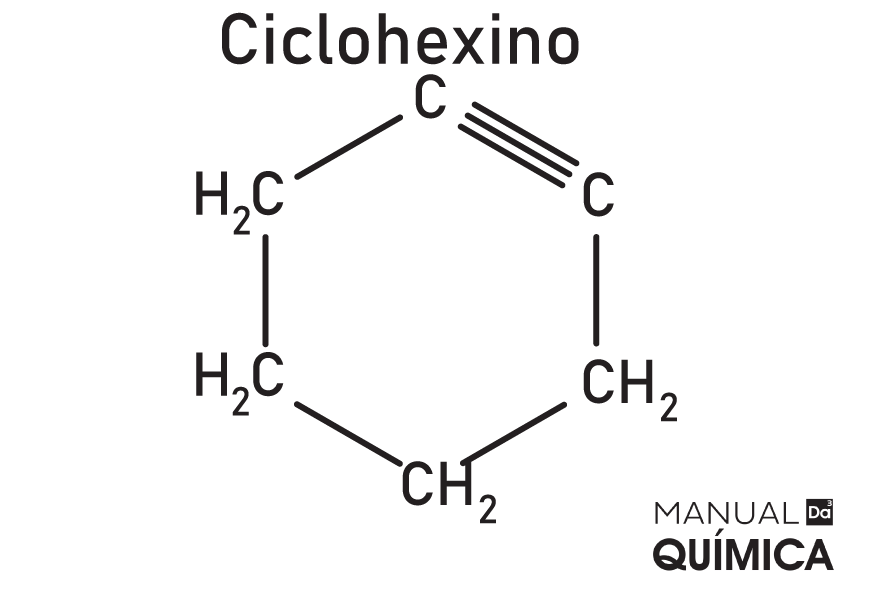
Aromáticos
A composição básica de um hidrocarboneto aromático é o benzeno, estrutura cíclica com seis carbonos e com duplas ligações que se alternam, fenômeno chamado de ressonância. Pode ocorrer aromaticidade em compostos com menos carbonos ou até com a presença de heteroátomos, como na molécula de furano. Vamos nos ater aqui aos hidrocarbonetos aromáticos.
Em hidrocarbonetos aromáticos, pode ocorrer a fusão de anéis benzênicos, originando, assim, outros compostos, como o naftaleno, molécula composta por dois anéis aromáticos, ou ainda o antraceno, que é formado por três anéis benzênicos. Podem acontecer ainda substituições de radicais do benzeno, formando, por exemplo, o tolueno.
Os compostos aromáticos apresentam-se geralmente em estado líquido, e o termo “aromático” dado aos compostos se deve ao odor forte e característico de vários compostos da classe. São utilizados como combustíveis para aviões, aditivos para aumento da octanagem dos motores, matéria-prima para borrachas sintéticas, fertilizantes e explosivos. São, em sua maioria, cancerígenos.
Os hidrocarbonetos aromáticos não seguem regras de nomenclatura como os demais hidrocarbonetos, pois cada estrutura aromática tem uma nomenclatura específica.
Exemplos:
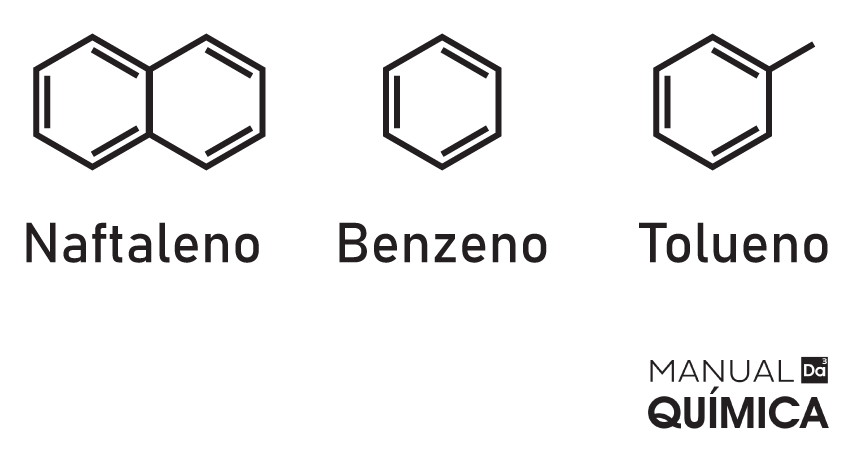
Exercícios resolvidos
Questão 1 — (Udesc) Analise as afirmativas em relação aos compostos abaixo. Assinale (V) para as afirmativas verdadeiras e (F) para as falsas.
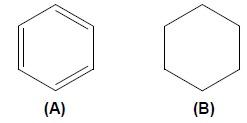
( ) O composto (B) é um hidrocarboneto cíclico, também conhecido como cicloparafina.
( ) O composto (B) é um hidrocarboneto aromático.
( ) O composto (A) apresenta aromaticidade.
( ) O composto (A) não é um hidrocarboneto, é conhecido como cicloparafina.
( ) O composto (B) é conhecido como anel aromático.
Assinale a alternativa que contém a sequência correta, de cima para baixo.
A) V F F V V
B) F V V F V
C) F F V V F
D) V V F F V
E) V F V F F
Resolução
Alternativa E.
• (V)
• (F) O composto B não é aromático, pois o que caracteriza a aromaticidade em hidrocarbonetos é a presença de um anel aromático com seis carbonos e insaturações alternadas. A molécula B possui apenas ligação simples.
• (V)
• (F) O composto A é constituído apenas por carbono e hidrogênio, portanto é um hidrocarboneto, mas não é um composto da função cicloalceno ou cicloparafina, por ter insaturações.
• (F) O composto B não possui insaturações nem duplas ligações alternadas, o que é característico de anéis aromáticos.
Questão 2 — (Unesp) O octano é um dos principais constituintes da gasolina, que é uma mistura de hidrocarbonetos. A fórmula molecular do octano é:
A) C8H18
B) C8H16
C) C8H14
D) C12H24
E) C18H38
Resolução
Alternativa A. Analisando a nomenclatura “octano”, podemos perceber que se trata de um alcano (terminação -ano) com oito carbonos (prefixo oct-). Sabendo que a fórmula geral para alcanos é CnH2n+2, então teremos: C8H2*8+2 = C8H18.
Questão 3 — (UFSCar-SP) Considere as afirmações seguintes sobre hidrocarbonetos.
I) Hidrocarbonetos são compostos orgânicos constituídos somente de carbono e hidrogênio.
II) São chamados de alcenos somente os hidrocarbonetos insaturados de cadeia linear.
III) Cicloalcanos são hidrocarbonetos alifáticos saturados de fórmula geral CnH2n.
IV) São hidrocarbonetos aromáticos: bromobenzeno, p-nitrotolueno e naftaleno.
São corretas as afirmações:
A) I e III, apenas.
B) I, III e IV, apenas.
C) II e III, apenas.
D) III e IV, apenas.
E) I, II e IV, apenas.
Resolução
Alternativa E. Apenas a afirmativa III está incorreta, pois diz que “cicloalcanos são hidrocarbonetos alifáticos…”. O termo alifático se aplica a hidrocarbonetos de cadeia aberta, e os cicloalcanos, como indica o prefixo “ciclo”, são hidrocarbonetos de cadeia fechada.