Formol
O formol é uma solução aquosa de formaldeído (ou metanal) empregada em muitos processos industriais. É uma substância tóxica e possui conhecido efeito carcinogênico.
Por Ana Luiza Lorenzen Lima
PUBLICIDADE
O formol é uma solução aquosa de formaldeído em concentração de 37% em massa ou 40% em volume. O formaldeído é o nome comum para o composto orgânico metanal, um aldeído formado por um único carbono.
Essa substância é de elevada toxicidade e contém efeito carcinogênico. Como é altamente volátil em temperatura ambiente, as principais formas de intoxicação são as vias respiratórias e os olhos. Até 2009, o formol era usado em processos de alisamento capilar no Brasil, mas foi proibido em razão do potencial tóxico.
Leia também: Amianto — uma resistente fibra mineral que teve seu uso proibido devido aos danos que causa à saúde
Resumo sobre formol
-
O formol é uma solução aquosa de formaldeído em concentração de 37% em massa ou 40% em volume.
-
O formaldeído é o nome comum para o metanal.
-
O metanal é um composto orgânico pertencente à função orgânica aldeído.
-
O metanal é um gás em temperatura ambiente, por isso é comercializado sob a forma de solução aquosa.
-
Muitos processos industriais utilizam formol.
-
Ele é usado na fabricação de tintas, colas, revestimentos, produtos derivados da madeira, preservação de material biológico, desinfetantes, produtos de limpeza, entre outros.
-
O formol apresenta elevada toxicidade e é carcinogênico.
Propriedades do formol
-
Fórmula química: CH2O.
-
Massa molecular: 30,01 g/mol-1.
-
Aparência: líquido incolor.
-
Densidade: 1,1 kg/m-3.
-
Ponto de fusão: -117 °C
-
Ponto de ebulição: -19,3 °C
-
Pressão de vapor: 17,2 mmHg (a 20 °C)
-
Outros nomes: metanal, formalina, aldeído fórmico, oxometano, oximetileno.
Características do formol
O formol é uma solução aquosa de formaldeído, também chamada de formalina. O formaldeído é o nome comum do composto orgânico metanal (CH2O), pertencente à função orgânica aldeídos, sendo o mais simples deles, com um único átomo de carbono.
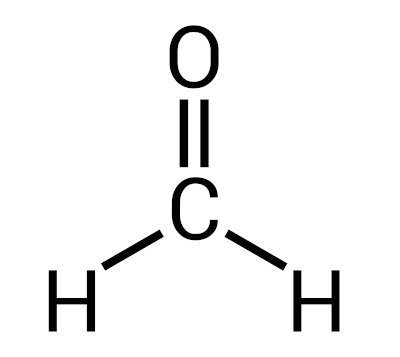
O formaldeído se apresenta como gás em temperatura ambiente e é um composto instável, decompondo-se com facilidade em metanol e dióxido de carbono. Em razão dessa instabilidade química, o formaldeído é comercializado sob a forma de solução aquosa, sendo conhecido como formol ou formalina.
O formol é preparado pela diluição do metanal em água, a um fator de 37% em massa ou 40% em volume. Mesmo o formol sendo uma solução aquosa, é comum se referir a ele como metanal.
Bastante volátil em temperatura ambiente, o formol apresenta elevada toxicidade (inclusive seus vapores), em razão da facilidade de intoxicação pelas vias aéreas, possuindo poder carcinogênico comprovado.
Em temperatura ambiente, o formol facilmente volatiliza em um gás incolor, inflamável, corrosivo e com um odor pungente característico. Além da água, o formol também é solúvel em álcool e ligeiramente solúvel em éter. Esse aldeído é instável quimicamente, sendo comum a reação com outros reagentes para a formação de substâncias poliméricas.
O formol está entre os produtos químicos mais utilizados na indústria, pois em razão da alta reatividade, pode ser usado em diversos procedimentos e é relativamente barato.
Apesar da toxicidade associada ao formol, esse produto pode ser encontrado na atmosfera, sendo formado em incêndios, processos de combustão, fábricas e incinerados. A emissão veicular de automóveis que não possuam catalisadores possui alta quantidade de formol.
Obtenção do formol
A principal rota de produção comercial do formol é a oxidação catalítica do metanol (álcool) na presença de ar e catalisadores de óxidos metálicos ou de prata.
No processo Formox, o metanal (HCOH) é gerado na reação entre o metanol e gás oxigênio, na presença de catalisador formado por uma mistura de óxidos de ferro e molibdênio. Esse processo é executado em temperatura de 300 a 400 °C.
\(\mathbf{CH_3\ OH+1/2\ O_2\longrightarrow HCOH+H_2 O}\)
No processo de dehidrogenação, a reação executada é a mesma, mas agora se aplicam catalisadores de prata, gerando o metanal por meio de duas reações simultâneas, oxidação e dehidrogenação do metanol.
\(\mathbf{CH_3\ OH+1/2\ O_2\longrightarrow HCOH+H_2\ O}\)
\(\mathbf{CH_3\ OH\longrightarrow HCOH+H_2}\)
O uso do catalisador de prata demanda que essa reação aconteça em aproximadamente 600 °C. Esse processo possui a vantagem de produzir, como subproduto, gás hidrogênio, o qual pode ser adequadamente coletado e usado em outras aplicações.
Os dois processos possuem vantagens e desvantagens, relacionadas ao gasto energético e ao tamanho de equipamentos necessários para executá-los em escala industrial.
Interessante: É comum a adição de 8 a 15% de metanol à solução aquosa de formaldeído, evitando processos de polimerização entre as moléculas de metanal.
Quais são as aplicações do formol?
As principais aplicações do formol são no setor industrial, onde participa do processo de produção uma infinidade de produtos e de procedimentos. Alguns exemplos são:
-
resinas, colas, adesivos, revestimentos e vernizas;
-
embalagens;
-
fertilizantes,
-
produtos de madeira prensada, como aglomerados e compensados;
-
tecidos;
-
revestimentos de produtos de papel;
-
desinfetantes e produtos de limpeza;
-
agente de preservação de tecidos, na área médica e funerária;
-
preservação de medicamentos, cosméticos e protetor solar.

O formol ocorre naturalmente no ambiente. Inclusive, é gerado em baixas quantidades no organismo humano, em virtude de processos metabólicos, e por alguns alimentos, como as frutas. O formol pode ser gerado naturalmente em processos de cozimento e assamento.
Precauções com o formol
O formol é um produto perigoso à saúde humana e animal. Possui um odor pungente, irritando mucosas, e está associado a certos tipos de câncer, sendo classificado como substância carcinogênica (potencial causadora de câncer).
O maior risco do formol está associado à sua evaporação em temperatura ambiente, sendo fácil a contaminação pelas vias aéreas e pelos olhos. Nesses casos, há irritação de olhos, nariz, garganta e trato respiratório.
O contato com o formol por inalação pode gerar reações cutâneas, dor de cabeça, asma, tonturas, náusea, vômito, fadiga, laringite, dores em articulações, falta de ar, entre outros sintomas. Em caso de ingestão, os sintomas são mais acentuados, podendo levar à morte.
Como o formol pode causar danos ao material genético, não há valores de concentração da substância em que a exposição seja segura.
É possível que ambientes internos registrem maiores valores de formol no ar em relação aos ambientes externos. Isso se explica pelo tempo de uso de objetos que contêm formol em sua formulação e que podem liberá-lo ao longo do tempo. A fumaça de cigarros possui elevada quantidade dessa substância.

Em 2000, o formol passou a ser permitido na composição de produtos de tratamento capilar, com o objetivo de alisamento e redução do volume dos fios. Em 2009, a Agência Nacional de Vigilância Sanitária (Anvisa) passou a proibir a presença de formol nesses produtos, bem como a comercialização em farmácias e supermercados, visando à proteção da saúde dos funcionários e usuários de salões de beleza.

História do formol
O formol foi descoberto em 1859 pelo químico russo Aleksandr Butlerov, mas apenas em 1867 essa substância foi quimicamente identificada e preparada controladamente por August Wilhelm von Hofmann, químico alemão, por meio de seus experimentos com metanol e platina.
A produção industrial de formol foi iniciada em 1882, quando os pesquisadores Bernhard Tollens e Oscar Loew melhoraram o processo de síntese proposto por Hofmann, aumentando a eficiência e rendimento.

Em 1889, o formol começou a ser comercializado pela empresa alemã Mercklin & Lösekann. Atualmente, o principal método de produção dessa substância é aquele proposto por Hofmann, oxidação catalítica do metanol, mas empregando catalisadores de melhor desempenho.
Saiba mais: Ácido fórmico — o ácido carboxílico que está presente na picada da formiga
Exercícios resolvidos sobre formol
Questão 1
(FCM) O metanal ou formaldeído (HCOH) é um gás incolor extremamente irritante para as mucosas. Pode ser obtido industrialmente pela reação do metanol (CH3OH) com oxigênio, em presença de catalisador, pressão e temperatura adequada, conforme a equação:
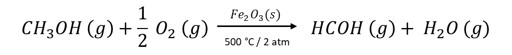
De acordo com a cinética da reação e com as substâncias envolvidas no processo, assinale a alternativa correta.
A) A reação ocorre mais rapidamente na temperatura de 250 °C.
B) Um aumento da concentração de metanol diminui a velocidade da reação.
C) A velocidade da reação é independente de modificações na pressão.
D) A função do Fe2O3(s) é diminuir a energia de ativação da reação.
E) A reação de produção do metanal exemplifica uma catálise homogênea.
Resolução:
Alternativa D
Item A incorreto. Como a reação ocorre mediante a temperatura de 500 °C, reduzir esse valor seria tornar a reação mais lenta.
Item B incorreto. O aumento da concentração de metanol aumentaria a velocidade da reação.
Item C incorreto. A variação de pressão interfere na velocidade da reação, pois há quantidades diferentes de mols de gás no lado dos reagentes e dos produtos.
Item D correto. O Fe2O3 é o catalisador cuja função é acelerar a reação pela diminuição da energia de ativação.
Item E incorreto. É catálise heterogênea, pois o catalisador é sólido, e as espécies envolvidas são gasosas.
Questão 2
(PUC) Além de ser utilizada na preparação do formol, a substância da fórmula mostrada na figura a seguir tem aplicação industrial na fabricação de baquelite.
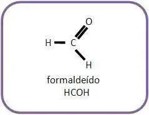
A função química e o nome oficial desse composto são, respectivamente:
A) aldeído e metanal.
B) éter e metoximetano.
C) ácido carboxílico e metanoico.
D) cetona e metanal.
E) álcool e metanol.
Resolução:
Alternativa A
Analisando a estrutura, verifica-se que a molécula pertence à função orgânica aldeído, pois apresenta o grupo funcional -CHO. Nesse caso, o nome da molécula deve ter o sufixo -al.
Moléculas orgânicas com apenas 1 átomo de carbono têm seu nome iniciado pelo prefixo met-. Dessa forma, o único item correto é o que contém aldeído e metanal.