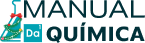Concentração em quantidade de matéria de íons
Para calcular a concentração em quantidade de matéria de íons em solução, basta escrever a equação iônica e relacionar a proporção estequiométrica com a concentração da solução.
Por Jennifer Rocha Vargas Fogaça
PUBLICIDADE
Conforme explicado no texto Concentração em quantidade de matéria, esse tipo de concentração de soluções relaciona a quantidade em mol de soluto que está presente no volume de 1 litro de solução. As duas fórmulas matemáticas usadas para calcular a concentração em mol/L são:
M = n1 ou M == __m1__
V M1 . V
n1 = quantidade de matéria (em mol) do soluto;
V = volume da solução (em litros);
m1 = massa (em gramas) do soluto;
M1 = massa molar do soluto (em g/mol).
Assim sendo, se temos uma solução de hidróxido de sódio (NaOH) com concentração igual a 3,0 mol/L, significa que, para cada litro dessa solução, há 3,0 mol de NaOH.
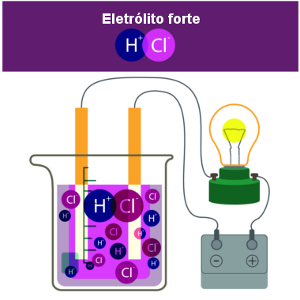
No entanto, o hidróxido de sódio é uma base que sofre dissociação em meio aquoso, liberando íons no meio. Veja: NaOH(aq) → Na+(aq) + OH-(aq).
Uma grande quantidade de soluções é iônica, por isso é muito comum expressar a concentração em quantidade de matéria dos íons. A concentração dos íons presentes no meio não é necessariamente igual à da solução ou igual entre eles. Para descobrirmos o valor exato de cada uma, temos que conhecer dois fatores principais:
1- Fórmula do soluto: é a partir da fórmula da substância dissolvida que podemos escrever a equação iônica. Isso é feito de acordo com a equação genérica a seguir:
1 AxBy → x A+y + y B-x
1 mol x mol y mol
A carga e o índice “1” foram escritos no caso da exemplificação do NaOH, mas nenhum dos dois precisa ser escrito: 1 NaOH(aq) → 1 Na+(aq) + 1 OH-(aq)
1 mol 1 mol 1 mol
2- Concentração em mol/L da solução: Com esses dados em mãos, basta relacionar a proporção estequiométrica dada pelos coeficientes da equação iônica com a concentração da solução.
No exemplo que estamos considerando, a proporção foi de 1 : 1 : 1. Então, se a concentração da solução é igual a 3,0 mol/L, a concentração em quantidade de matéria de cada um dos íons no meio também é a mesma. Veja:
1 NaOH(aq) → 1 Na+(aq) + 1 OH-(aq)
Proporção: 1 mol 1 mol 1 mol
Solução (1,0 mol/L): 3,0 mol/L 3,0 mol/L 3,0 mol/L
Isso significa que, em cada litro da solução, há 3,0 mol de cátions Na+ e 3,0 mol de ânions OH-.
Vamos ver outro exemplo: Considere uma solução 0,02 mol/L de Fe(NO3)3(aq). Qual será a concentração em mol/L dos íons nessa solução?
Resolução:
1 Fe(NO3)3(aq) → 1 Fe3+(aq) + 3 NO3-1
Proporção: 1 mol 1 mol 3 mol
Solução (0,02 mol/L): 0,02mol/L 0,02 mol/L 0,06 mol/L
Observe que a concentração dos íons NO3- é o triplo (3 . 0,02 = 0,06) da concentração dos íons Fe3+ e da solução.
Por Jennifer Fogaça
Graduada em Química