Soluções Químicas
As soluções químicas são formadas por misturas homogêneas de duas ou mais substâncias e podem estar nos três estados físicos (sólido, líquido e gasoso).
Por Jennifer Rocha Vargas Fogaça

PUBLICIDADE
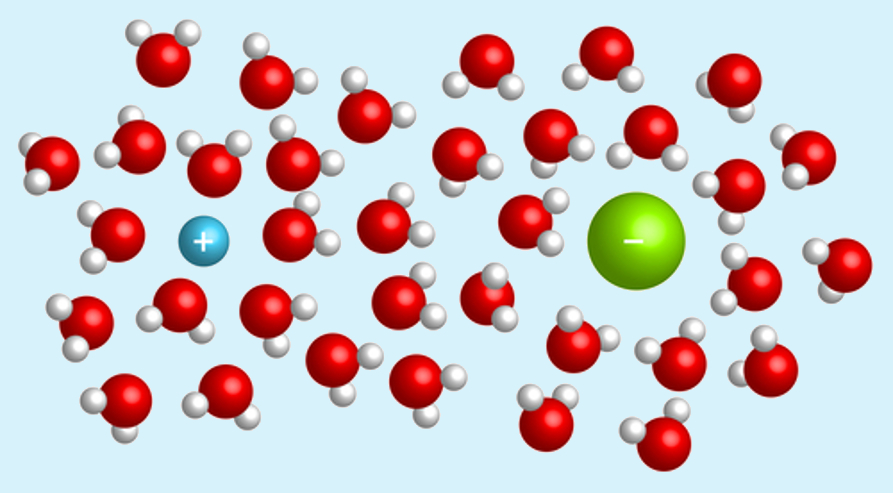
Soluções são sistemas homogêneos formados pela mistura de duas ou mais substâncias.
As soluções são constituídas de dois componentes: o soluto, que é o que se dissolve e se encontra em menor quantidade, e o solvente, que é o componente em maior quantidade e que atua dissolvendo o soluto.
Por exemplo, quando misturamos o sal na água, produzimos uma solução em que o sal é o soluto e a água é o solvente.
Devido à sua capacidade de dissolver uma grande quantidade de substâncias, a água é denominada de solvente universal.
Em determinadas situações podem surgir dúvidas quanto à determinação do soluto e do solvente. Um exemplo é quando se misturam partes iguais de álcool etílico e água, em que as duas substâncias dissolvem entre si infinitamente. Assim, essa determinação se torna uma simples questão operacional e qualquer um dos dois pode ser classificado como solvente, dependendo da utilidade.
Na maioria dos casos, porém, é possível identificar quem atua como soluto e quem atua como solvente.
A principal característica das soluções é serem homogêneas, pois isso significa que o soluto está dissolvido de modo uniforme por toda a sua extensão. Isso é importante porque mostra que as soluções possuem propriedades iguais em todos os seus pontos. Se um técnico colher várias amostras de determinada solução, todas terão as mesmas propriedades, pontos de fusão e ebulição, densidade e composição.
Mas existem outras características importantes que distinguem as soluções verdadeiras, que são:
-
As partículas do soluto são menores que 1 nm: Isso significa que nem mesmo com um ultramicroscópio a mistura deixa de ser homogênea. Isso é importante porque existem casos de misturas que parecem ser soluções a olho nu, mas que na verdade são misturas heterogêneas quando olhamos no microscópio.
Não pare agora... Tem mais depois da publicidade ;)
Dois exemplos são o leite e o sangue. Abaixo vemos a imagem desses compostos, que na verdade não são soluções:
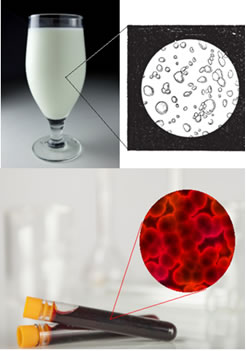
Leite e sangue vistos sob microscópio
-
Seus componentes não podem ser separados por métodos físicos, apenas químicos: Isso é resultado do tamanho de suas partículas dispersas, que não podem ser retidas por um filtro e também não se sedimentam sob a ação de uma ultracentrífuga.
O sangue, por exemplo, conforme já dito, não é uma solução verdadeira, e isso pode ser visto na figura abaixo, em que seus componentes foram separados pela ação de uma ultracentrífuga:
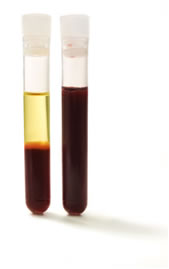
Sangue centrifugado
Já no caso de separarmos, por exemplo, uma solução de sal e água, seria necessário usar um processo químico, como a destilação.
Geralmente, quando nos referimos a soluções químicas pensamos num sólido dissolvido num líquido. No caso das soluções usadas em laboratório, a maioria é assim, porém existem soluções nos três estados físicos. Veja alguns exemplos:

Exemplos de soluções químicas nos três estados físicos
Aproveite para conferir nossas videoaulas sobre o assunto: