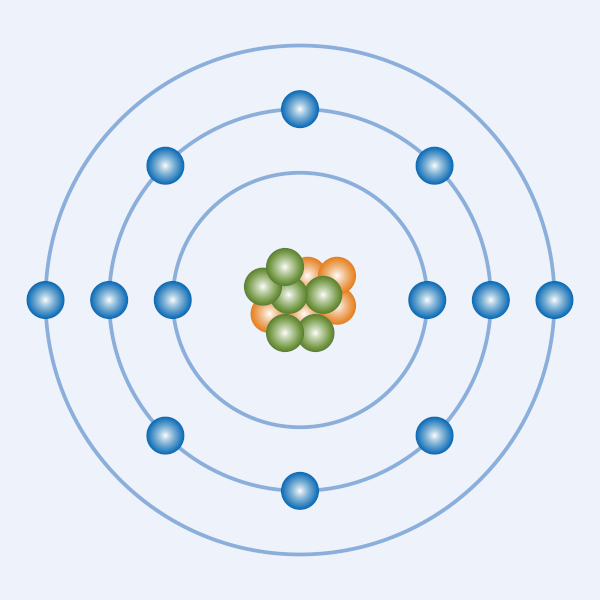
Nêutrons
Nêutrons são partículas eletricamente neutras que estão localizadas no núcleo atômico.
Por Stéfano Araújo Novais
PUBLICIDADE
Os nêutrons são partículas subatômicas localizadas no núcleo, junto com os prótons. Sua principal característica é o fato de serem eletricamente neutros. Além disso, um nêutron possui massa praticamente idêntica à de um próton, sendo levemente maior.
Os nêutrons foram descobertos apenas em 1932, por James Chadwick. Contudo, Ernest Rutherford já sugeria a presença de cargas neutras no núcleo em 1920 e, inclusive, cunhou o termo nêutron para essas partículas.
Os nêutrons são essenciais para produção de energia nuclear, sendo utilizados para induzir diversas reações de transmutação nuclear, como a fissão nuclear do urânio.
Leia também: Elétron — partícula subatômica que possui carga negativa
Resumo sobre nêutrons
-
Os nêutrons são partículas subatômicas presentes no núcleo atômico.
-
São eletricamente neutros, com massa aproximadamente igual à do próton.
-
O número de nêutrons pode ser determinado pelo Número de Massa (A).
-
Os nêutrons mantêm o núcleo atômico coeso por conta da força forte.
-
Os nêutrons são importantes para as reações de transmutação nuclear.
-
Os nêutrons foram descobertos em 1932 por James Chadwick.
Características do nêutron
Os nêutrons são partículas subatômicas que estão presentes no núcleo dos átomos. São eletricamente neutros, ou seja, possuem uma carga elétrica zero, e sua massa é aproximadamente igual à do próton (1,675 x 10-27 kg).
Os nêutrons não conseguem existir fora do núcleo atômico, possuindo um tempo médio de existência de 14 minutos e 39 segundos.
A carga elétrica zero do nêutron já foi comprovada experimentalmente, mas ele não é uma partícula oca. Os nêutrons são, na mecânica quântica, chamados de bárions, já que são formados por um quark up e dois quarks down.
Como determinar o número de nêutrons?
Os nêutrons podem ser determinados através do Número de Massa do átomo, representado pela letra A. Isso porque entre as três partículas subatômicas — prótons, elétrons e nêutrons —, apenas as que estão no núcleo possuem massa considerável. Por isso, o Número de Massa para um átomo se dá pela equação:
A = Z + n
A letra Z representa o número atômico (número de prótons), e n é o número de nêutrons.
Exemplo:
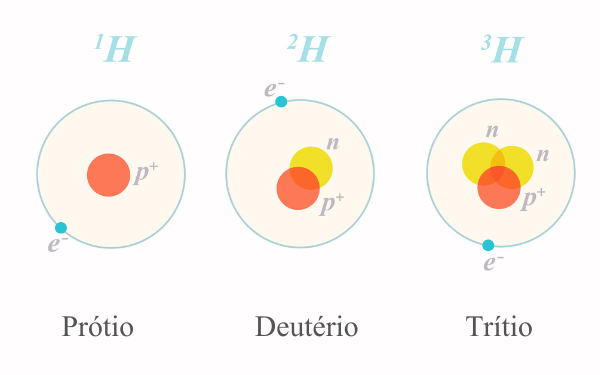
Determinar o número de nêutrons do isótopo 56Fe.
O isótopo 56 do ferro possui Número de Massa igual a 56. Já o elemento químico ferro possui Número Atômico igual a 26. Assim, o número de nêutrons é calculado como:
56 = 26 + n
n = 30
Logo, esse isótopo possui 30 nêutrons.
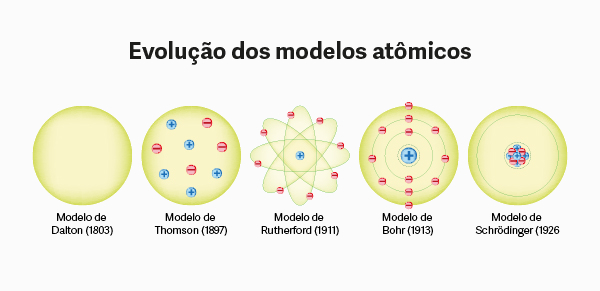
Leia também: Evolução dos modelos atômicos — a história dos estudos sobre o átomo
Para que serve o nêutron?
O nêutron é muito importante para a estabilidade do núcleo atômico. Uma vez que prótons, por serem cargas de mesmo sinal, repelem-se, o núcleo atômico é mantido coeso por meio de uma força atrativa entre prótons e nêutrons (na verdade, a interação ocorre entre os quarks e glúons dessas duas partículas).
Essa força atrativa é muito intensa e, não à toa, recebe o nome de força forte. Para se ter ideia, estima-se que essa força seja 2000 vezes maior que a força eletromagnética.
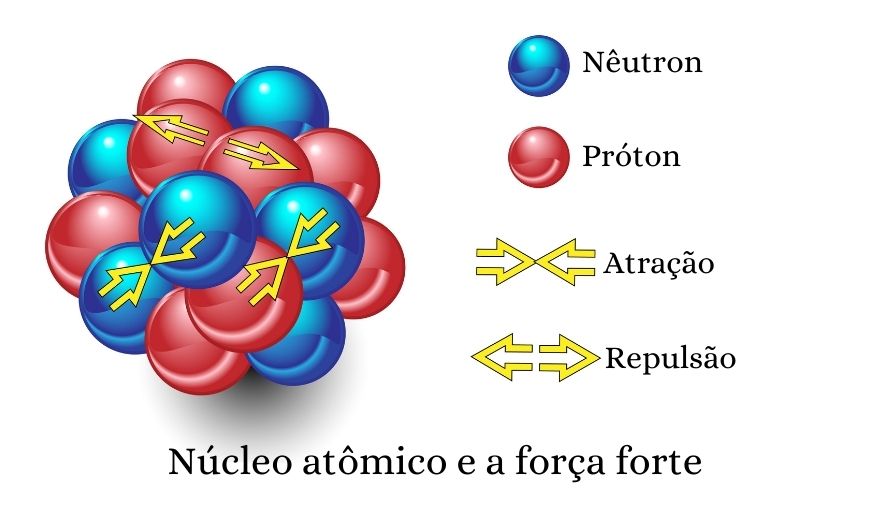
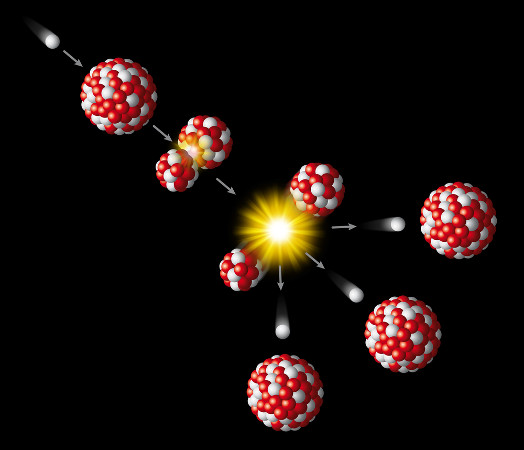
Os nêutrons também desempenham papel importante nas reações nucleares, pois induzem diversos processos de transmutação nuclear. Na fissão nuclear, por exemplo, um nêutron bombardeia um núcleo atômico, o qual se rompe em núcleos atômicos menores, o que caracteriza o processo de fissão nuclear. Nesse processo, nêutrons também são formados, os quais seguirão para fazer a fissão de outros núcleos, desenvolvendo-se então uma reação em cadeia.
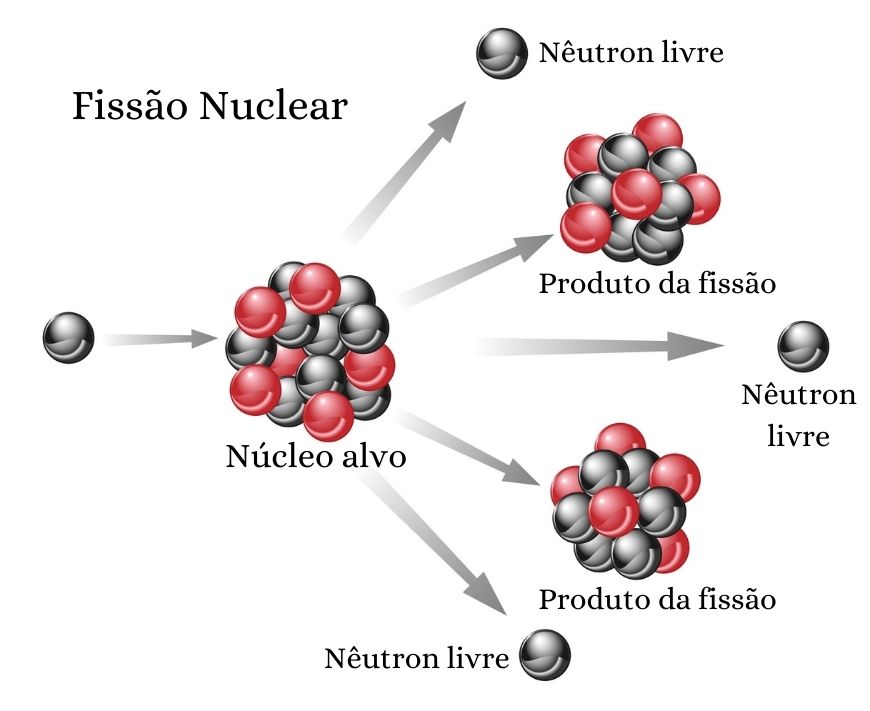
Descoberta do nêutron
Após os experimentos de Ernest Rutherford acerca da estrutura atômica, percebeu-se que o número de prótons de um átomo era insuficiente para justificar sua massa. Já se sabia que a massa do próton era cerca de 1836 vezes maior que a massa do elétron e, em um primeiro momento, aventou-se a hipótese de que poderiam existir elétrons no núcleo atômico junto aos prótons.
Por exemplo, o isótopo 14N teria, na verdade, 14 prótons no núcleo e, para que o mesmo fosse eletricamente neutro, deveriam existir sete elétrons no núcleo. Essa hipótese ganhava força, pois já se sabia da emissão da radiação beta por parte do núcleo, constituída por elétrons emitidos a partir do núcleo. Contudo, posteriormente, a ideia de um “elétron nuclear” começou a encontrar resistência nas bases da mecânica quântica, e experimentos e avanços teóricos na área foram enfraquecendo a hipótese de um elétron nuclear.
![Arte retratando o físico inglês James Chadwick.[1]](https://static.manualdaquimica.com/2021/10/james-chadwick.jpg)
Em 1931, Walther Bothe e Herbert Becker descobriram que o bombardeio de núcleos de berílio por partículas alfa oriundas do polônio produzia uma radiação altamente penetrante. A partir desses estudos, em 1932, James Chadwick publica um artigo em que relata experimentos com essa radiação aguda e conclui que esta consistia, na verdade, de nêutrons, partículas de massa 1 e carga 0.
Segundo Chadwick, no bombardeio do átomo de berílio ocorria a seguinte reação de transmutação:
![]()
Pela descoberta do nêutron, Chadwick foi laureado com o Prêmio Nobel de Física de 1935.
Leia também: Próton — a segunda partícula subatômica a ser descoberta
Exercícios resolvidos sobre nêutrons
Questão 1
(Enem 2009) Os núcleos dos átomos são constituídos de prótons e nêutrons, sendo ambos os principais responsáveis pela sua massa. Nota-se que, na maioria dos núcleos, essas partículas não estão presentes na mesma proporção. O gráfico mostra a quantidade de nêutrons (N) em função da quantidade de prótons (Z) para os núcleos estáveis conhecidos.
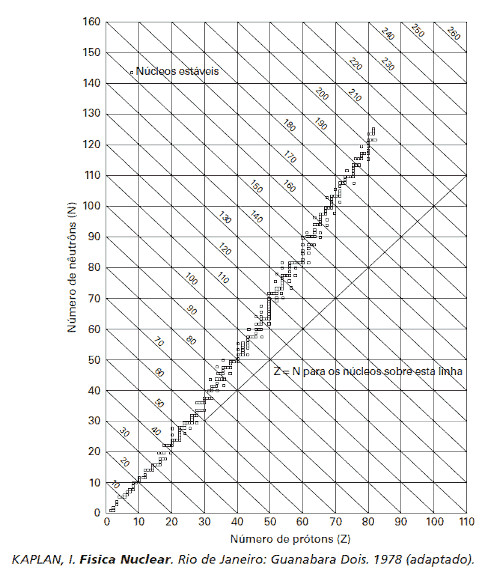
O antimônio é um elemento químico que possui 50 prótons e possui vários isótopos ― átomos que só se diferem pelo número de nêutrons. De acordo com o gráfico, os isótopos estáveis do antimônio possuem
a) entre 12 e 24 nêutrons a menos que o número de prótons.
b) exatamente o mesmo número de prótons e nêutrons.
c) entre 0 e 12 nêutrons a mais que o número de prótons.
d) entre 12 e 24 nêutrons a mais que o número de prótons.
e) entre 0 e 12 nêutrons a menos que o número de prótons.
Resolução
Ao observar o gráfico, devemos localizar no eixo horizontal (número de prótons) o número 50, correspondente ao número de prótons dos antimônio. Ao avaliar a linha para 50 prótons, percebe-se que os núcleos estáveis (pequenas esferas sobre as linhas) para o antimônio têm início um pouco depois de 60 nêutrons e terminam um pouco depois de 70 nêutrons, conforme percebe-se ao rebater o valor das pequenas esferas no eixo vertical. Assim, os isótopos estáveis do antimônio possuem entre 12 e 24 nêutrons a mais que o número de prótons. Deve-se, portanto, marcar a letra C.
Questão 2
(UERJ 2014) Uma forma de identificar a estabilidade de um átomo de qualquer elemento químico consiste em relacionar seu número de prótons com seu número de nêutrons em um gráfico denominado diagrama de estabilidade, mostrado a seguir.
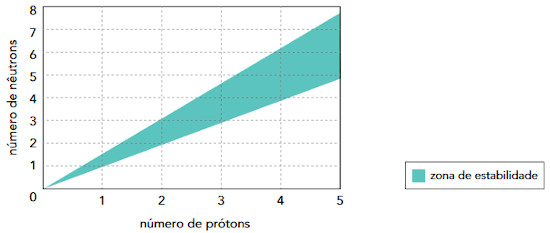
São considerados estáveis os átomos cuja interseção entre o número de prótons e o de nêutrons se encontra dentro da zona de estabilidade mostrada no gráfico.
Verifica-se, com base no diagrama, que o menor número de massa de um isótopo estável de um metal é igual a:
a) 2
b) 3
c) 6
d) 9
Resolução
A questão se refere a um metal. Além disso, solicita o menor número de massa de um isótopo estável deste metal. O metal de menor número de massa possível na Tabela Periódica é o Lítio (Z = 3) e, por isso, deve-se escolher, no eixo horizontal, o valor 3.
Ao subir para 3 prótons na linha, percebe-se que a zona de estabilidade se inicia quando o número de nêutrons é também igual a 3.
Assim, o menor número de massa para um isótopo estável do metal (lítio) é:
A = Z + n
A = 3 + 3
A = 6
Sendo assim, a alternativa correta é a letra C.
Créditos da imagem
[1] roseed abbas / Shutterstock.com