Átomo
A primeira teoria atômica, de Dalton, afirmava que o átomo era a partícula fundamental da matéria. O desenvolvimento científico mostrou que existem diversas partículas menores.
Por Laysa Bernardes Marques de Araújo
PUBLICIDADE
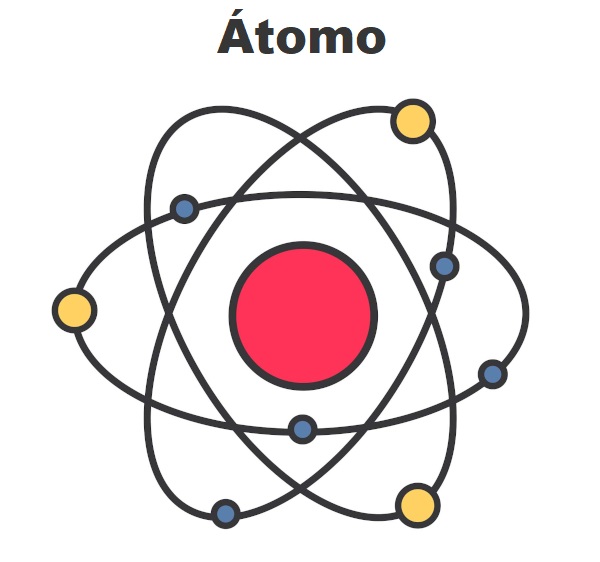
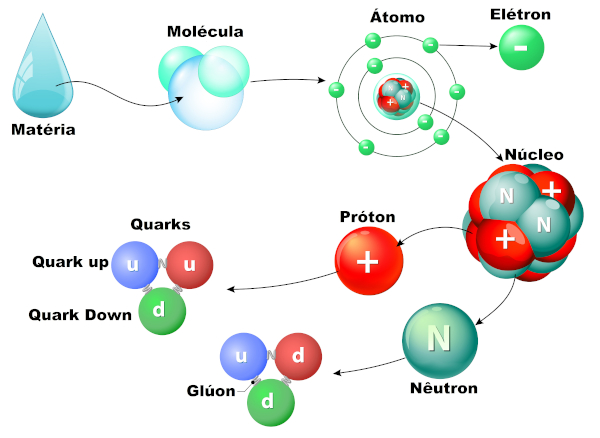
O átomo é a partícula base formadora de toda matéria. Hoje temos catalogadas 118 espécies atômicas, que são representadas na tabela periódica e classificadas de acordo com as características físico-químicas de cada uma.
A hipótese de uma partícula indivisível, substancial à matéria, foi lançada pela primeira vez na Grécia Antiga por Demócrito, que foi desacreditado pelos seguidores de Aristóteles. Séculos depois Dalton formulou a primeira teoria atômica, na qual afirmava que o átomo era a menor partícula existente, sendo indivisível e indestrutível.
Depois de Dalton, várias teóricos tentaram explicar o átomo, sua estrutura e interação com o meio. O desenvolvimento científico provou que, apesar de a palavra átomo significar “indivisível”, hoje sabemos que existem diversas partículas subatômicas, ou seja, partículas intrínsecas ao átomo, como quarks, léptons e mésons.
Leia também: Evolução dos modelos atômicos ao longo da história
O que é átomo?
Átomo é a partícula microscópica que é base da formação de toda e qualquer substância. Por muito tempo, acreditou-se que ele era a menor parte da matéria, o indivisível. Tanto que a palavra átomo provém do grego e significa aquilo que não se parte.
No decorrer dos anos, foram formuladas teorias atômicas, cada uma delas com uma estrutura atômica diferente. A evolução dessas teorias foi agregando à composição do átomo partículas ainda menores, como os prótons e elétrons. Hoje, apesar de se manter o nome átomo, já sabemos que não se trata de um elemento indivisível e que existem outras partículas menores, chamadas de partículas subatômicas.
Estrutura do átomo
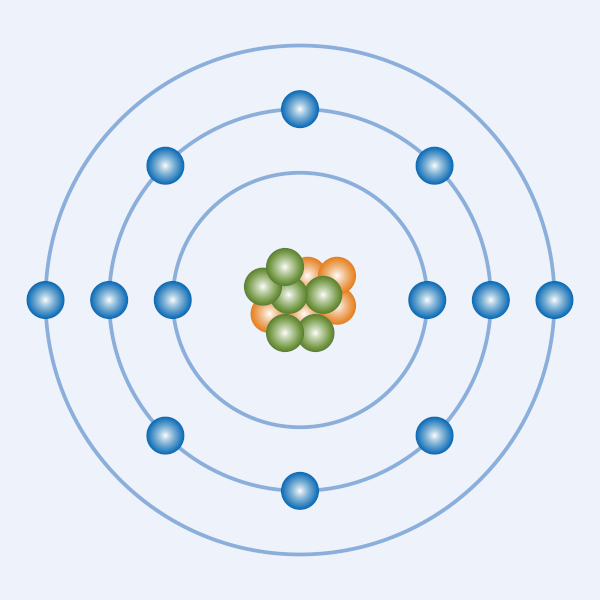
A última teoria atômica aceita foi o modelo atômico de Schrodinger, que propõe que o átomo é composto por um núcleo, onde se encontram os prótons (partículas positivas) e os nêutrons (partículas sem carga), rodeados por uma nuvem de elétrons (partículas negativas) chamada eletrosfera, que se mantém conectada ao núcleo por força eletromagnética. Uma exceção a essa estrutura são os hidrogênios, que não têm nêutrons, e os cátions desse elemento não possuem elétrons.
Existem ainda as partículas fundamentais chamadas quarks, que compõem os prótons e nêutrons. Essas partículas fundamentais organizam-se formando outras partículas maiores. O próton é formado por dois quarks up e um quark down, além dos glúons, que é outro de tipo de partícula subatômica e mediador das forças que unem os quarks. O nêutron, por sua vez, é formado por um quark up e dois quarks down mais os glúons.
Propriedades do átomo
-
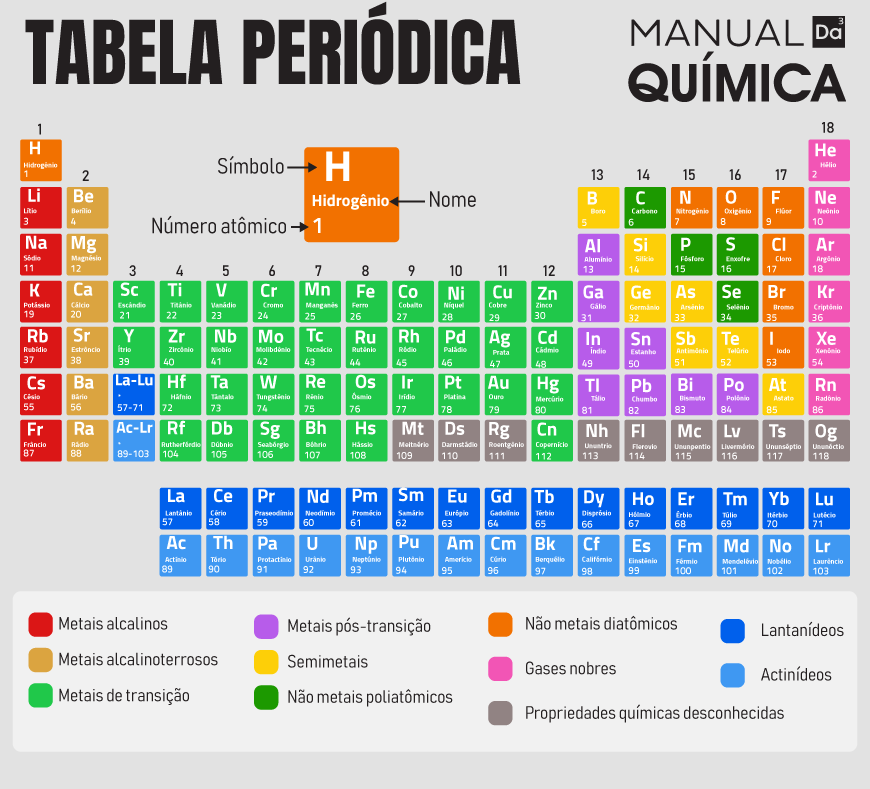
Raio atômico: é a distância entre o elétron na camada mais externa da eletrosfera e o núcleo do átomo. Para se determinar o tamanho do átomo, foi estabelecido que a eletrosfera organiza-se de forma circular em torno do núcleo, o que possibilita estipular um raio atômico. Constatou-se que esse raio que mede toda a eletrosfera do átomo é 10 mil vezes maior que o seu núcleo. Pode haver variações nessas medidas, pois o raio atômico de cada espécie contrai ou expande conforme posicionamento, interações externas e campos energéticos.
-
Massa atômica: é a somatória da massa dos elementos que compõem o átomo. Como o elétron tem massa desprezível (muito pequena), a massa de um átomo é composta pelos nêutrons e prótons. Na tabela periódica, a informação de massa é dada logo abaixo do símbolo de cada elemento. A unidade de medida é u (unidade de massa) ou g/mol. O valor estipulado para u tem como referência o carbono-12 – um isótopo muito abundante do carbono – e equivale a massa de um doze avos do átomo de carbono-12, que é 1,66054.10-24g.
-
Número atômico: representado pela letra P ou Z, é a quantidade de prótons existentes no núcleo de uma espécie atômica. Ele distingue um átomo do outro e é a propriedade atômica utilizada para ordenar os elementos na tabela periódica. A informação sobre o número de prótons de um elemento é disponibilizada na tabela periódica: fica acima do símbolo cada átomo.

-
Radioatividade: alguns átomos, como o urânio (U) e o césio (Cs), possuem propriedades radioativas, que é a capacidade de emitir naturalmente energia em forma de partículas e onda (alfa, beta ou gama), acarretando o fenômeno do decaimento radioativo, que é a transformação de um átomo radioativo em outro elemento mais estável.
Leia também: Organização da tabela periódica
Semelhança atômica
Semelhança atômica é o agrupamento de elementos de acordo com as características em comum, como número de massa, prótons, nêutrons e carga elétrica. A massa atômica é dada pela somatória do número de prótons e nêutrons (A=Z+N), e a carga elétrica de um elemento no estado natural é igual ao número atômico. De acordo com a semelhança atômica, os átomos podem ser classificados em isótopos, isóbaros, isótonos e isoeletrônicos.
-
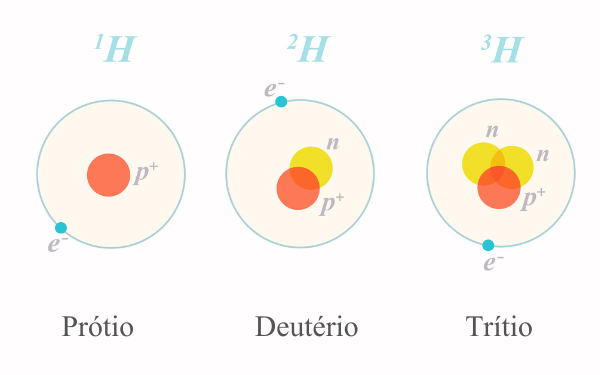
Isótopos: é uma classificação dada às espécies atômicas que podem apresentar diferentes massas. Sendo assim, o número de prótons mantém-se, mas os nêutrons e a massa atômica variam. Esse é o caso do carbono-12 ( 126C ), carbono-13 (136C) e carbono-14 (14C6). Perceba que os três carbonos possuem seis prótons, mas a massa varia e, consequentemente, o número de nêutrons.
-
Isóbaros: são diferentes átomos que apresentam o mesmo número de massa. Nesse caso, o número atômico varia, pois se trata de substâncias diferentes, mas o número de massa é igual. Exemplos: nitrogênio (147N) e carbono-14 (14C6).
-
Isótonos: átomos com o mesmo número de nêutrons, mas com número atômico e de massa diferentes. Exemplos: berílio (104Be) e boro (115B).
-
Isoeletrônicos: são os elementos que possuem mesma carga elétrica, em estado natural ou iônico (quando há ganho ou perda de elétrons). Exemplos: íons sódio (11Na+), oxigênio (8O2-) e neônio (10Ne). Perceba que os três elementos possuem 10 elétrons. No caso do sódio ionizado, houve a retirada de 1 elétron, portanto, dos 11 que havia na sua eletrosfera, restaram 10. O oxigênio, em seu estado fundamental, tem 8 elétrons, mas o íon O2- recebe 2 elétrons, ficando, portanto, com carga elétrica igual a 10. O neônio já possuía 10 elétrons em seu estado natural.
Para saber mais sobre, leia: Semelhança atômica.
História do átomo
No começo de tudo, quando se pensou em estudar a base de todas as coisas, uma corrente de filósofos da Grécia Antiga acreditava que os elementos responsáveis pela formação do Universo e de tudo que nele existe eram água, terra, ar e fogo.
Ainda na Grécia Antiga, pouco tempo depois, a expressão átomo foi aplicada aos estudos de Demócrito (460 a.C – 370 a.C.), cientista, matemático e filósofo. Para ele, o átomo era a menor parte de toda a matéria existente. Demócrito deu continuidade à teoria atomística, trabalho iniciado por seu mestre, Leucipo.
A tese desenvolvida por Demócrito defendia que toda matéria era formada por pequenas, indivisíveis e indestrutíveis partículas. Ela não foi bem aceita pelos estudiosos, e o assunto só foi retomado séculos depois, com a ascensão da Ciência Moderna, no início do século XVIII.

Em 1803, John Dalton, considerado o pai da teoria atômica moderna, finalizou seu trabalho sobre a absorção dos gases, o qual foi de fundamental importância para o desenvolvimento do estudo do átomo. De acordo com Dalton, o átomo era a única explicação plausível para o comportamento dos gases que ele estudava.
Após constatar a existência de uma partícula formadora de toda a matéria, diversas hipóteses foram lançadas. Segundo Dalton, haveria uma espécie de átomo com diferentes propriedades para cada elemento químico. O desafio da ciência nas últimas décadas do século XIX foi identificar essas espécies atômicas.
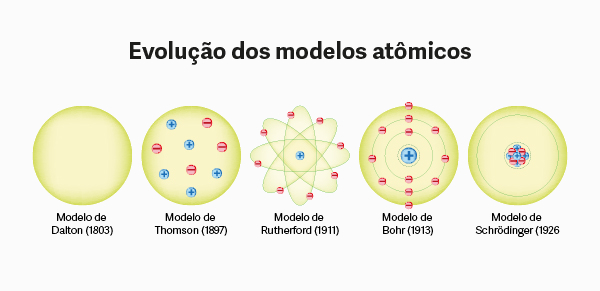
Modelos atômicos
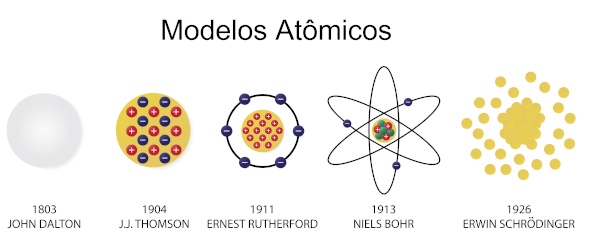
→ Modelo atômico de Dalton
Entre 1803 e 1807, Dalton propôs o primeiro modelo atômico, a primeira hipótese de como seria a estrutura de um átomo. Para ele, o átomo era a menor parte da matéria e não poderia mais ser dividido. Assim, seria uma partícula esférica, maciça, indivisível e indestrutível. O modelo atômico de Dalton ficou conhecido como “bola de bilhar”. Para saber mais, leia: Modelo atômico de Dalton.
→ Modelo atômico de Thomson
No séc. VI a.C., o filósofo Tales de Mileto já havia constatado experimentalmente a existência de elétrons. Mas só em 1897 Thomson concluiu, por meio de um experimento com tubos de raios catódicos, a existência de partículas menores que o átomo e carregadas com carga elétrica negativa. Foi nesse momento que foi descoberta a primeira partícula subatômica: o elétron.
A partir dessa descoberta, foi necessária a criação de um novo modelo, e foi Joseph John Thomson que propôs o modelo atômico formado por uma esfera de cargas positivas com elétrons espalhados em sua superfície. Esse modelo ficou conhecido como “modelo do pudim de passas”. Para saber mais, leia: Modelo atômico de Thomson.
→ Modelo atômico de Rutherford
Em 1911 Rutherford lançou uma nova teoria atômica, contestando a estrutura proposta por Thomson. Hans Geiger e Ernest Marsden foram precursores do modelo atômico proposto por Rutherford.
Supervisionado por Rutherfod, Marsden realizou, em 1909, o experimento da folha de ouro, no qual foi feita uma emissão radioativa de partículas alfa em uma folha de ouro. Com isso, foi observado que muitas partículas atravessavam a folha, mas algumas eram refletidas ou desviadas. A conclusão foi que o núcleo do átomo possuía carga positiva e estava rodeado por elétrons de carga negativa.
Rutherford concluiu também que praticamente toda a massa do átomo estaria concentrada no núcleo, que, mesmo assim, em questões dimensionais, seria muito pequeno em relação ao átomo como um todo.
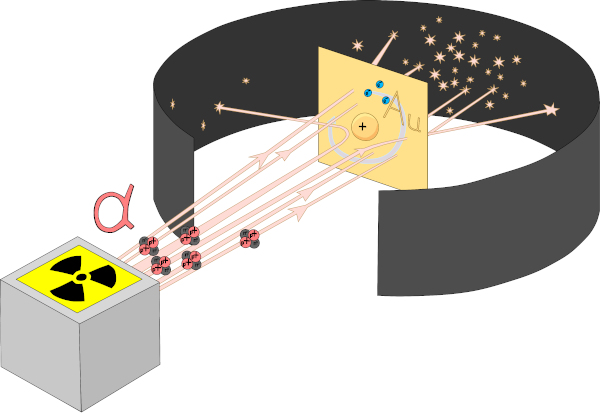
Na proposta atômica de Rutherford, havia um ponto que entrava em conflito com a física clássica: o movimento infinito dos elétrons em torno do núcleo atômico. De acordo com a teoria do eletromagnetismo, as partículas com carga negativa que orbitam o núcleo perderiam energia de movimento e iriam, progressivamente, caindo de forma espiralada de encontro com o núcleo. Essa foi a falha no modelo atômico de Rutherford.
Niels Bohr, aluno e colega de trabalho, além de admirador da teoria criada pelo seu mentor, utilizando-se dos estudos quânticos de Albert Einstein e da teórica quântica da energia de Max Planck, aprimorou o trabalho de Rutherford. Para saber mais, leia: Modelo atômico de Rutherford.
→ Modelo atômico de Rutherford-Bohr
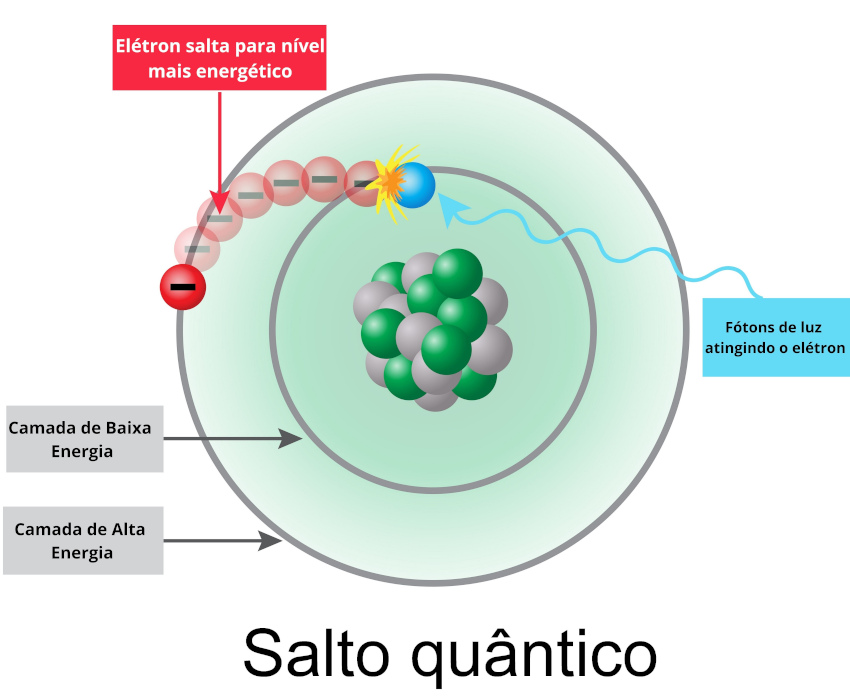
O modelo atômico de Rutherford-Bohr propõe níveis de energia para explicar a distribuição eletrônica do átomo. De acordo com Bohr, a eletrosfera de um elemento é formada por camadas, e as camadas mais distantes do núcleo são as mais energizadas. Os elétrons giram em órbitas fixas, e só existe mudança de orbital ou retirada de elétrons se o átomo for submetido a uma energia externa.
Ainda segundo Bohr, quando um elétron recebe quantum (energia, que pode ser em forma de luz, calor, eletricidade), ele tende a ir para uma camada mais externa, liberar a energia em fótons (luz) e retornar à camada de origem. Esse processo é chamado de salto quântico ou salto energético. Bohr descobriu também a existência de uma partícula sem carga que compunha o núcleo do átomo juntamente aos prótons: os nêutrons. Para saber mais, leia: Modelo atômico de Rutherford-Bohr.
→ Modelo atômico de Schrödinger
A partir do modelo atômico de Rutherford-Bohr, começaram a surgir questionamentos a respeito das partículas subatômicas, principalmente sobre o comportamento dos elétrons e a delimitação da eletrosfera. Foi então enunciado por Werner Heisenberg o Princípio da Incerteza. De acordo com esse princípio, era impossível determinar posição e velocidade de uma partícula. À luz dessa afirmação, não tendo como estipular dados exatos sobre a localização dos elétrons, Schrodinger, por meio de infinitos cálculos matemáticos, determinou uma região de maior probabilidade de se encontrar um elétron. Foi então definido que a eletrosfera teria um formato de nuvem, uma “nuvem de elétrons”.
Curiosidades sobre átomo
-
O chumbo é o elemento com maior peso atômico, apresentando 207,9766521 u.
-
Existem 288 nuclídeos primordiais, que são núcleos atômicos que existem desde antes da formação do Sistema Solar e ainda se encontram sem alterações nas características nucleares do átomo.
-
Em 1911, quando se começou a estudar o núcleo atômico, foi dada a largada para a descoberta de novas partículas menores que o átomo. Exemplos dessas partículas são os quarks, léptons e mésons. Hoje se conhecem diversas subpartículas que explicam a relação entre massa e energia de um átomo ou agregado atômico.
-
Para se ter uma noção da dimensão de um átomo, para cada gota de água (H2O), há dois mil trilhões de átomos de oxigênio mais quatro mil trilhões de átomos de hidrogênio.
-
Dalton, autor do primeiro modelo atômico, sequer era químico. Era um professor de inglês que tinha afinidade com a química, e suas pesquisas e descobertas foram fruto de um “passatempo”.
-
As espécies atômicas são identificadas pelo número de prótons. Não existem átomos de diferentes espécies com o mesmo número de prótons.
-
Os prótons e nêutrons são responsáveis por aproximadamente 99,94% de toda a massa do átomo, que é dada em u (unidade de massa atômica).
Exercícios resolvidos sobre átomo
1. (Enem 2019) Um teste de laboratório permite identificar alguns cátions metálicos ao introduzir uma pequena quantidade do material de interesse em uma chama de bico de Bunsen para, em seguida, observar a cor da luz emitida. A cor observada é proveniente da emissão de radiação eletromagnética ao ocorrer:
a) a mudança da fase sólida para a fase líquida do elemento metálico.
b) combustão dos cátions metálicos provocada pelas moléculas de oxigênio da atmosfera.
c) diminuição da energia cinética dos elétrons em uma mesma órbita na eletrosfera atômica.
d) transição eletrônica de um nível mais externo para outro mais interno na eletrosfera atômica.
e) remoção dos elétrons que se encontram no estado fundamental de energia para níveis mais energéticos.
Resposta: letra d. De acordo com a teoria atômica de Bohr, o salto quântico de um elétron se dá ao absorver energia, indo para uma camada mais externa do átomo. Ao retornar ao estado original, o elétron libera a energia na forma de fótons, luz. Cada espécie atômica apresenta uma cor característica de luz emitida.
2. (Enem) Em 1808, Dalton publicou o seu famoso livro intitulado Um novo sistema de filosofia química (do original A New System of Chemical Philosophy), no qual continha os cinco postulados que serviam como alicerce da primeira teoria atômica da matéria fundamentada no método científico. Esses postulados são numerados a seguir:
1. A matéria é constituída de átomos indivisíveis.
2. Todos os átomos de um dado elemento químico são idênticos em massa e em todas as outras propriedades.
3. Diferentes elementos químicos têm diferentes tipos de átomos; em particular, seus átomos têm diferentes massas.
4. Os átomos são indestrutíveis e nas reações químicas mantêm suas identidades.
5. Átomos de elementos combinam com átomos de outros elementos em proporções de números inteiros pequenos para formar compostos.
Após o modelo de Dalton, outros modelos baseados em outros dados experimentais evidenciaram, entre outras coisas, a natureza elétrica da matéria, a composição e organização do átomo e a quantização da energia no modelo atômico.
OXTOBY, D.W.; GILLIS, H. P.; BUTLER, L. J. Principles of Modern Chemistry. Boston: Cengage Learning, 2012 (adaptado).
Com base no modelo atual que descreve o átomo, qual dos postulados de Dalton ainda é considerado correto?
a) 1
b) 2
c) 3
d) 4
e) 5
Resposta: letra e. O 5° postulado de Dalton é coerente com o atual modelo atômico, visto que a formação molecular se dá entre átomos inteiros e de acordo com a necessidade de estabilização eletrônica de cada um. A partir das interações moleculares, há compostos maiores.
3- Qual foi a falha na teoria atômica de Rutherford?
a) A teoria de Rutherford não considerou a existência de elétrons na estrutura atômica.
b) A teoria atômica de Rutherford não admitia que o núcleo atômico tivesse carga negativa.
c) Para Rutherford, só existia um tipo de átomo, que seria formador de todo tipo de matéria orgânica e inorgânica.
d) Rutherford equivocou-se ao dizer que a eletrosfera de um átomo tinha um raio muitas vezes maior que o núcleo.
e) A falha de Rutherford foi descrever o movimento dos elétrons em torno do núcleo sem considerar a perda energética.
Resposta: letra e. Em sua teoria atômica, Rutherford considerou que os elétrons se movimentavam de forma elíptica em torno do núcleo, o que ia de encontro aos princípios da física clássica, pois, se o núcleo tem carga positiva e os elétrons têm carga negativa, pelo princípio de conservação da energia, teríamos uma queda progressiva dos elétrons em direção ao núcleo, e não um movimento infinito.