Misturas e substâncias puras
As substâncias puras têm só um constituinte e possuem as propriedades físicas constantes, já as misturas são formadas por duas ou mais substâncias.
Por Jennifer Rocha Vargas Fogaça

PUBLICIDADE
Um dos objetos principais de estudo da química é a matéria, que pode ser definida como tudo aquilo que ocupa lugar no espaço. A matéria apresenta-se basicamente de duas formas: como uma substância pura ou como uma mistura. Essas duas formas, por sua vez, são subdivididas em outras classificações, sendo que as principais são:
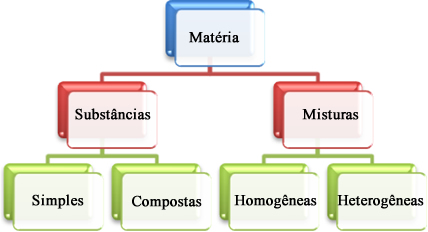
Classificação da matéria em substâncias puras e misturas
Vamos entender cada uma delas:
1. Substâncias puras ou simplesmente substâncias: São aquelas constituídas somente por um tipo de constituinte (moléculas, átomos, íons, fórmulas unitárias etc.) e possuem pontos de fusão e ebulição constantes a uma dada pressão, além de densidade bem definida, em determinada pressão e temperatura.
Por exemplo, a água destilada é uma substância pura porque ela é constituída somente por moléculas de H2O. Ao nível do mar (pressão de 1 atm), ela possui ponto de fusão exatamente igual a 0ºC, ponto de ebulição igual a 100ºC e, a 3,98 ºC, a sua densidade é de 1,0 g/cm3.

A água destilada é um exemplo de substância pura
1.1. Substâncias simples: São aquelas formadas unicamente por átomos de um mesmo elemento químico.
Um exemplo é o enxofre rômbico mostrado abaixo, cuja fórmula é S8, sendo que as suas moléculas são formadas por oito átomos de enxofre ligados em forma de anel (S8). Como só possui átomos de enxofre, ele é uma substância simples. Outros exemplos são: gás oxigênio (O2), gás hidrogênio (H2), ferro (Fe), gás hélio (He), alumínio (A?) etc.

O enxofre rômbico é um exemplo de substância simples
1.2. Substância compostas ou simplesmente compostos: São formados por átomos de mais de um tipo de elemento químico.
Por exemplo, as moléculas da água destilada mencionada são formadas por dois tipos de átomos (hidrogênio e oxigênio). Portanto, ela é uma substância composta. Outros exemplos são: gás carbônico (CO2), álcool (C2H5OH) e sal de cozinha (cloreto de sódio -NaC?).
2. Misturas: São formadas por duas ou mais substâncias puras. As misturas não possuem densidades fixas porque elas variam, dependendo da quantidade de cada componente na mistura. Não possuem ponto de fusão e ebulição constantes, mas sim intervalos de temperatura em que se começa e termina a mudança de estado físico.
Por exemplo, a água que bebemos não é pura, porque tanto a água mineral quanto a que sai da torneira possui uma grande quantidade de substâncias dissolvidas. Se olhar no rótulo de uma água mineral, por exemplo, você verá que as principais espécies químicas encontradas na maioria das águas minerais são: íons cálcio, magnésio, potássio, sódio, cobre, bário, antimônio, arsênio, cádmio, chumbo, manganês, mercúrio, níquel, cromo, cianeto, borato, fosfato, bicarbonatos, sulfatos, sulfetos, nitratos, cloretos e ferro.
Portanto, a água mineral é na realidade uma mistura.
2.1. Misturas homogêneas (soluções verdadeiras): São aquelas misturas que apresentam uma única fase, ou seja, todo o seu aspecto é uniforme.
A água mineral citada anteriormente é um exemplo de mistura homogênea, em que não conseguimos ver a separação entre os componentes.

A água mineral é uma mistura homogênea
Outros exemplos de misturas homogêneas são: o ar (formado por uma mistura de vários gases, sendo que os principais são o nitrogênio (N2) e o oxigênio (O2)), o soro fisiológico (mistura de água e sal), o soro caseiro (água + sal + açúcar), o álcool etílico (etanol e água), entre outros.
Observação: A mistura deve ser homogênea mesmo ao se olhar em um microscópio. O que não é o caso, por exemplo, do leite e do sangue, que parecem ser homogêneos a olho nu, mas que, quando olhamos no microscópio, vemos seus vários componentes. As misturas homogêneas também não são separadas por métodos físicos, como a centrifugação, que é uma técnica que facilmente separa os componentes do leite e do sangue.
2.2. Misturas heterogêneas: São aquelas misturas que apresentam duas ou mais fases.
Um exemplo é a mistura de água e óleo mostrada abaixo. Visto que não se misturam e o óleo é menos denso que a água, formam-se duas fases (sistema bifásico), com o óleo na parte superior.

Mistura heterogênea de água e óleo
Outros exemplos são: granito (mistura de quartzo, mica e feldspato), água e café, água e areia etc.
Observação: Existem também casos de sistemas heterogêneos que são constituídos de substâncias puras. Isso ocorre quando temos em um mesmo sistema uma substância em diferentes estados físicos, como é o caso de um copo com água e gelo (ambos são H2O, mas observamos duas fases). É claro que ambos devem ser formados por água destilada.

Água e gelo são um sistema heterogêneo formado por uma substância pura
Aproveite para conferir nossas videoaulas sobre o assunto: